
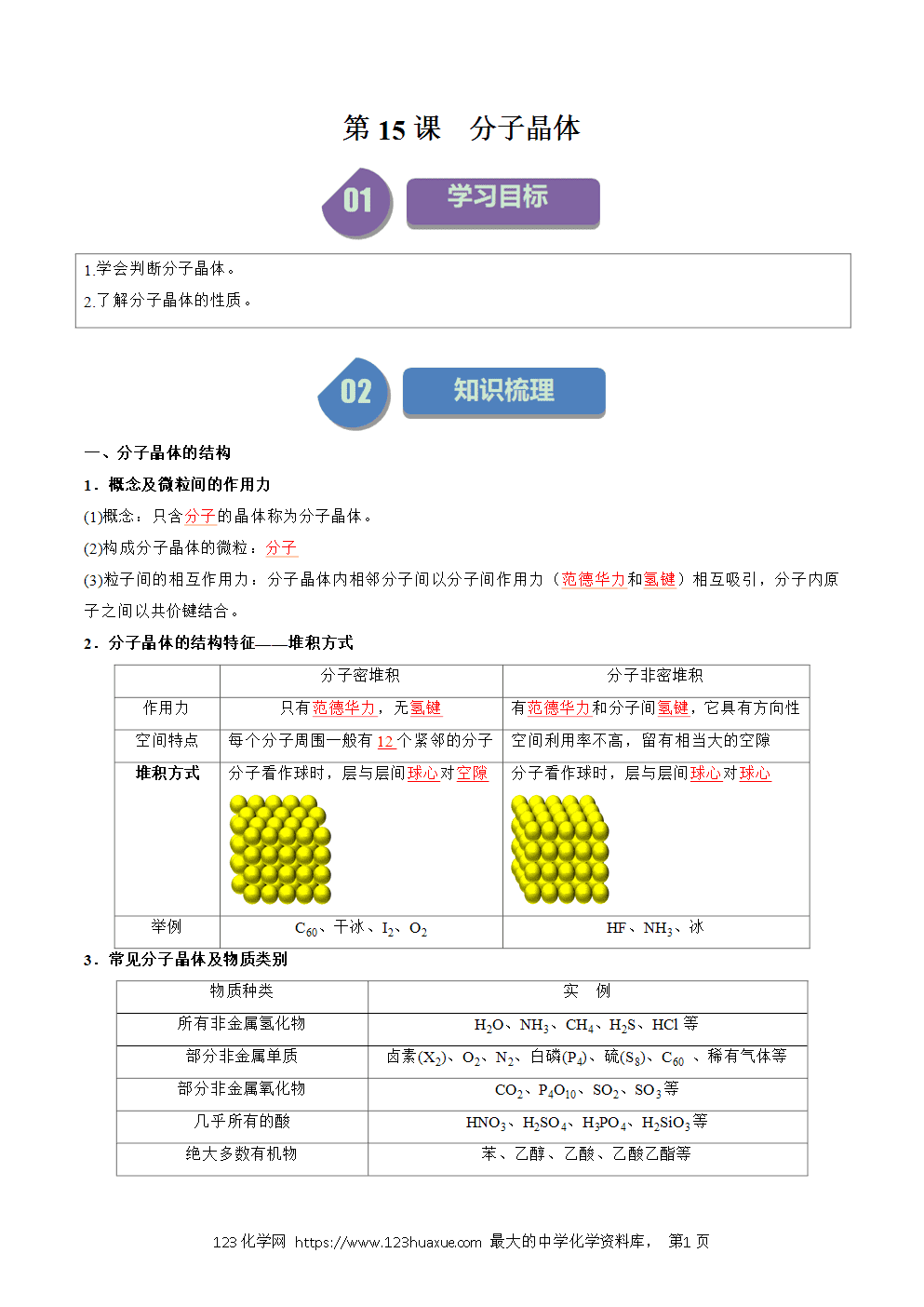
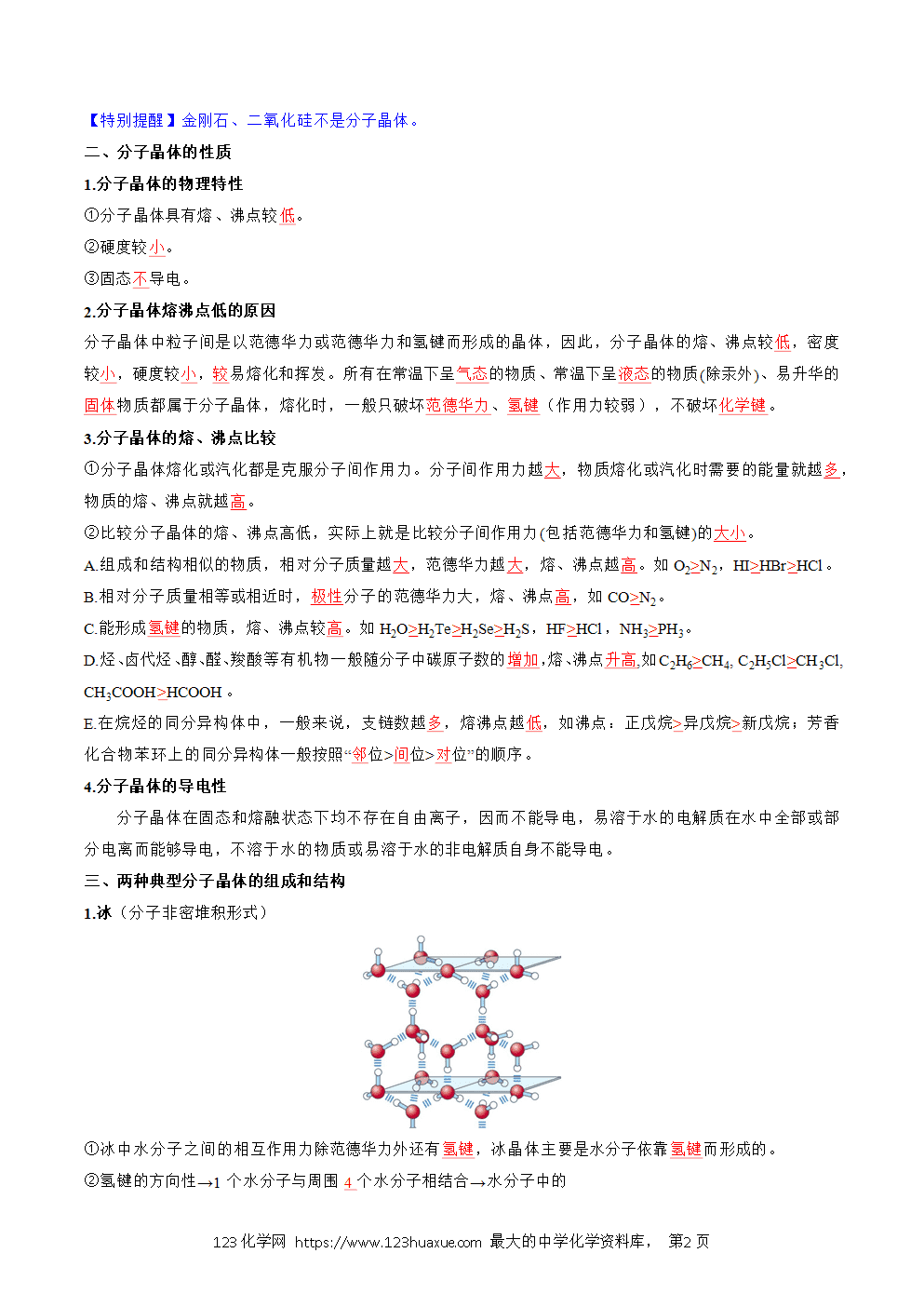








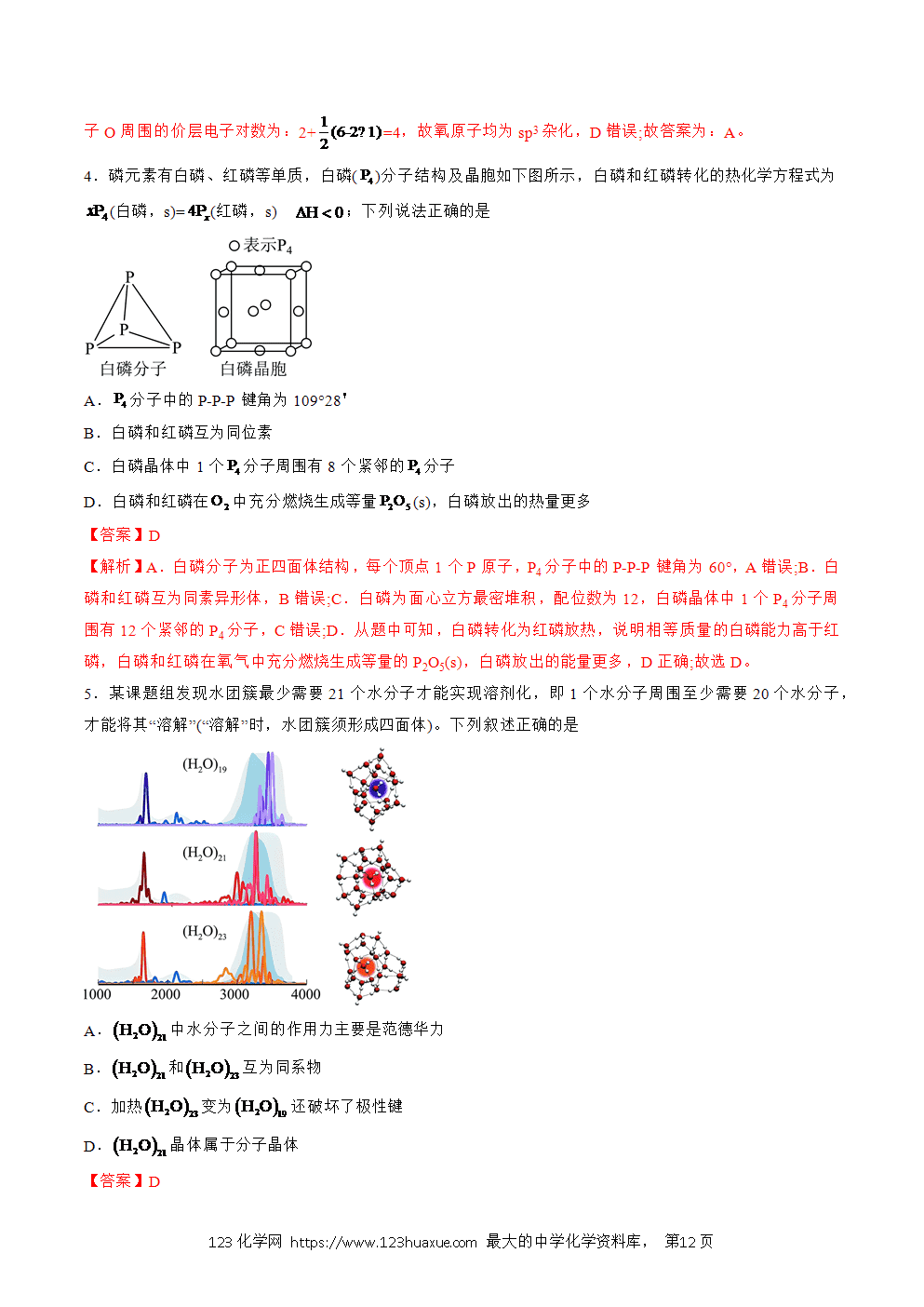


分子晶体的性质
1.分子晶体的物理特性
①分子晶体具有熔、沸点较低。
②硬度较小。
③固态不导电。
2.分子晶体熔沸点低的原因
分子晶体中粒子间是以范德华力或范德华力和氢键而形成的晶体,因此,分子晶体的熔、沸点较低,密度较小,硬度较小,较易熔化和挥发。所有在常温下呈气态的物质、常温下呈液态的物质(除汞外)、易升华的固体物质都属于分子晶体,熔化时,一般只破坏范德华力、氢键(作用力较弱),不破坏化学键。
3.分子晶体的熔、沸点比较
①分子晶体熔化或汽化都是克服分子间作用力。分子间作用力越大,物质熔化或汽化时需要的能量就越多,物质的熔、沸点就越高。
②比较分子晶体的熔、沸点高低,实际上就是比较分子间作用力(包括范德华力和氢键)的大小。
A.组成和结构相似的物质,相对分子质量越大,范德华力越大,熔、沸点越高。如O2>N2,HI>HBr>HCl。
B.相对分子质量相等或相近时,极性分子的范德华力大,熔、沸点高,如CO>N2。
C.能形成氢键的物质,熔、沸点较高。如H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3。
D.烃、卤代烃、醇、醛、羧酸等有机物一般随分子中碳原子数的增加,熔、沸点升高,如C2H6>CH4, C2H5Cl>CH3Cl, CH3COOH>HCOOH。
E.在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低,如沸点:正戊烷>异戊烷>新戊烷;芳香化合物苯环上的同分异构体一般按照“邻位>间位>对位”的顺序。