 高考复习精品专题PPT课件《分子的空间结构-杂化轨道理论简介》,
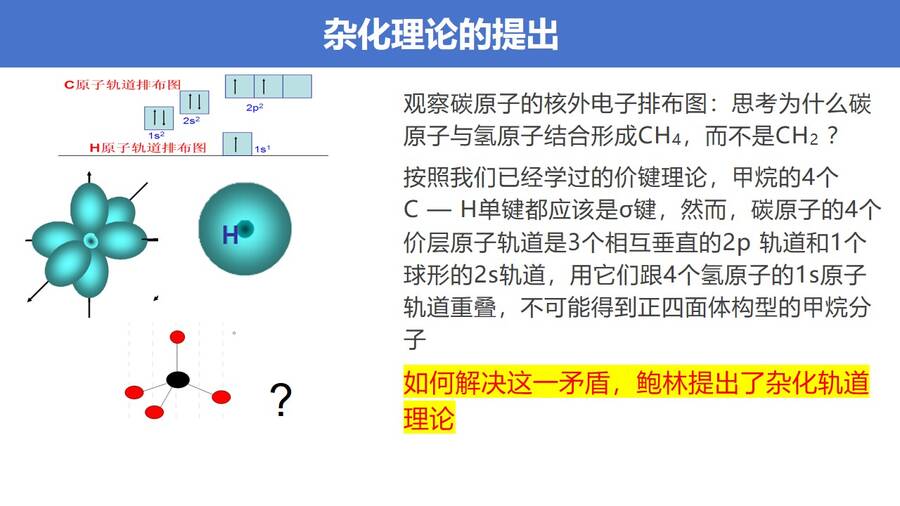
高考复习精品专题PPT课件《分子的空间结构-杂化轨道理论简介》,观察碳原子的核外电子排布图:思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
按照我们已经学过的价键理论,甲烷的4个C — H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体构型的甲烷分子
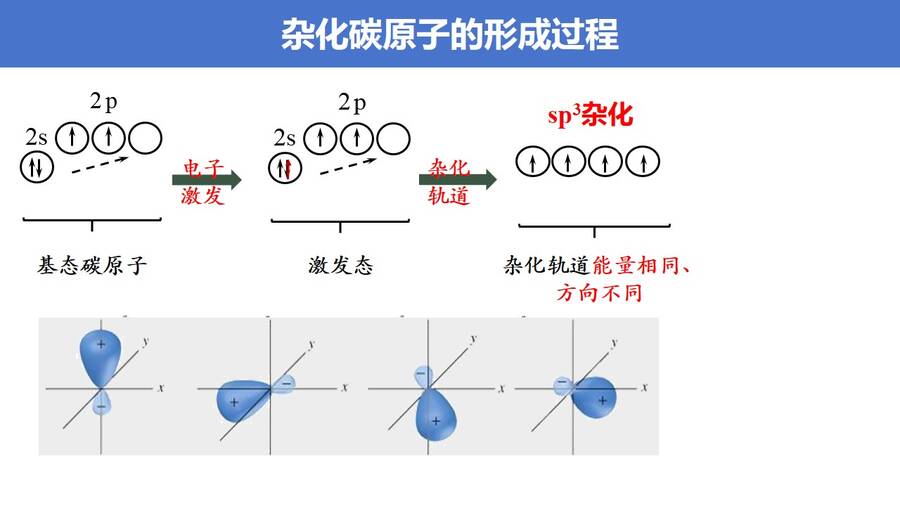
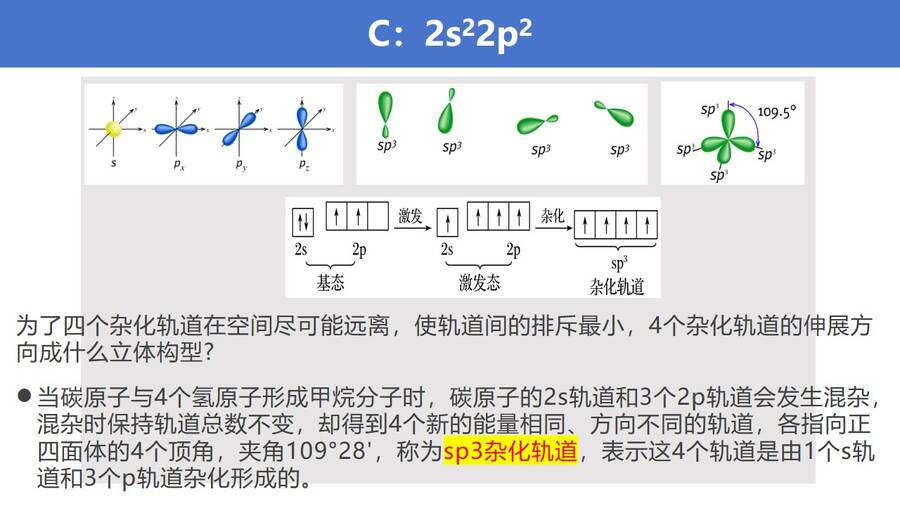
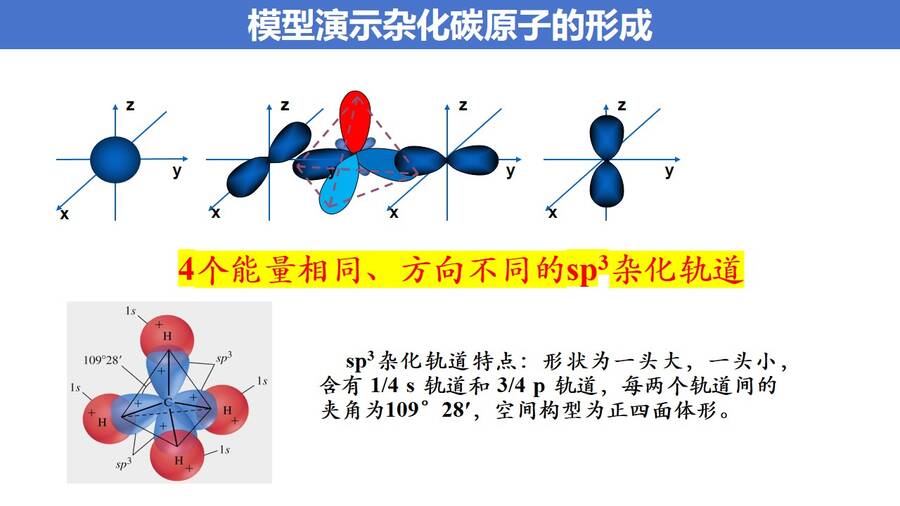
如何解决这一矛盾,鲍林提出了杂化轨道理论



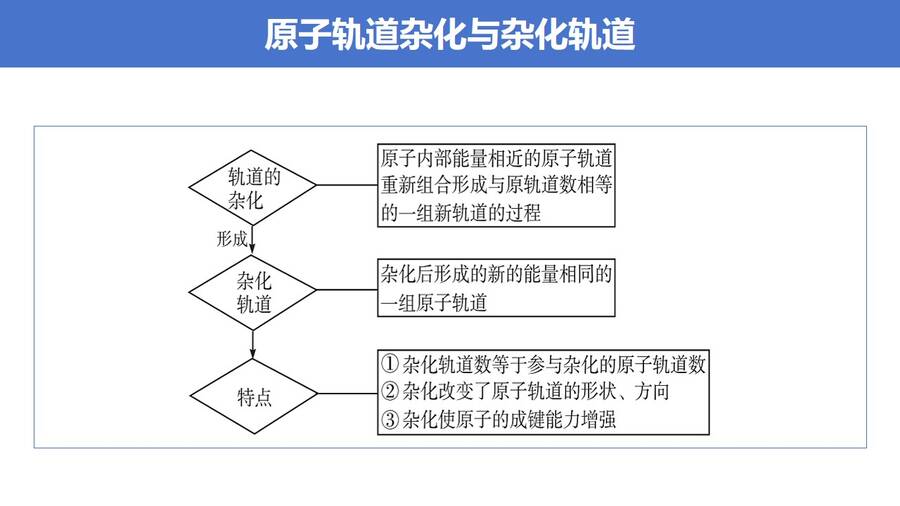
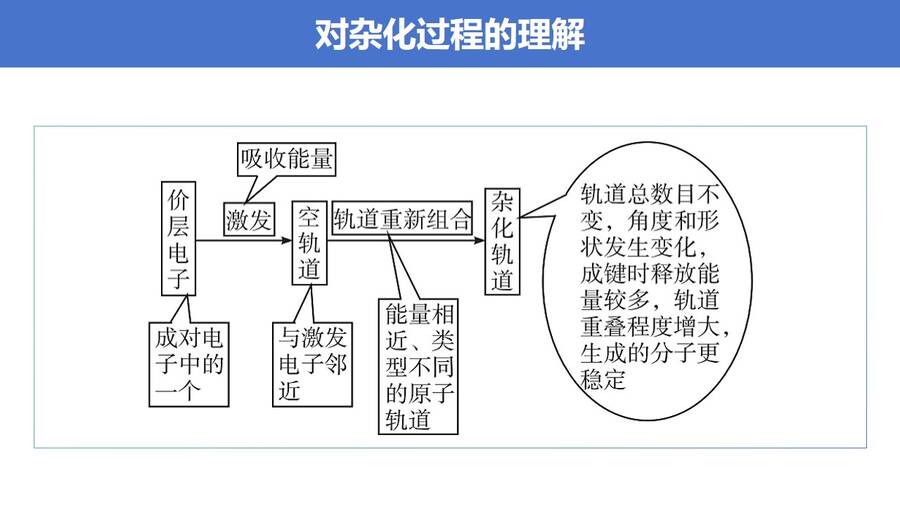
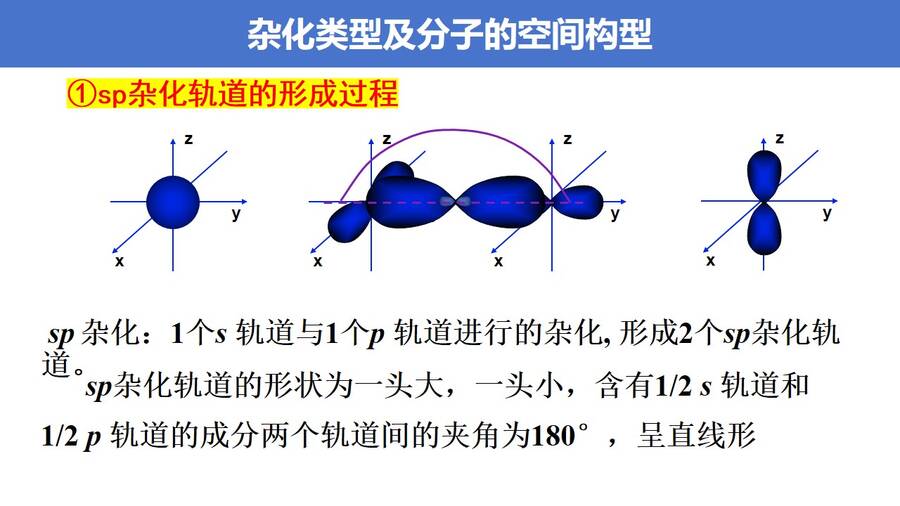
 高考复习精品专题PPT课件《分子的空间结构-杂化轨道理论简介》,
高考复习精品专题PPT课件《分子的空间结构-杂化轨道理论简介》,观察碳原子的核外电子排布图:思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
按照我们已经学过的价键理论,甲烷的4个C — H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体构型的甲烷分子
如何解决这一矛盾,鲍林提出了杂化轨道理论









