











杂化轨道理论简介
1.杂化轨道的含义
杂化轨道理论是一种价键理论,是鲍林为了解释分子的空间结构提出的。
(1)轨道的杂化:在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
(2)杂化轨道:原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)杂化轨道的特点
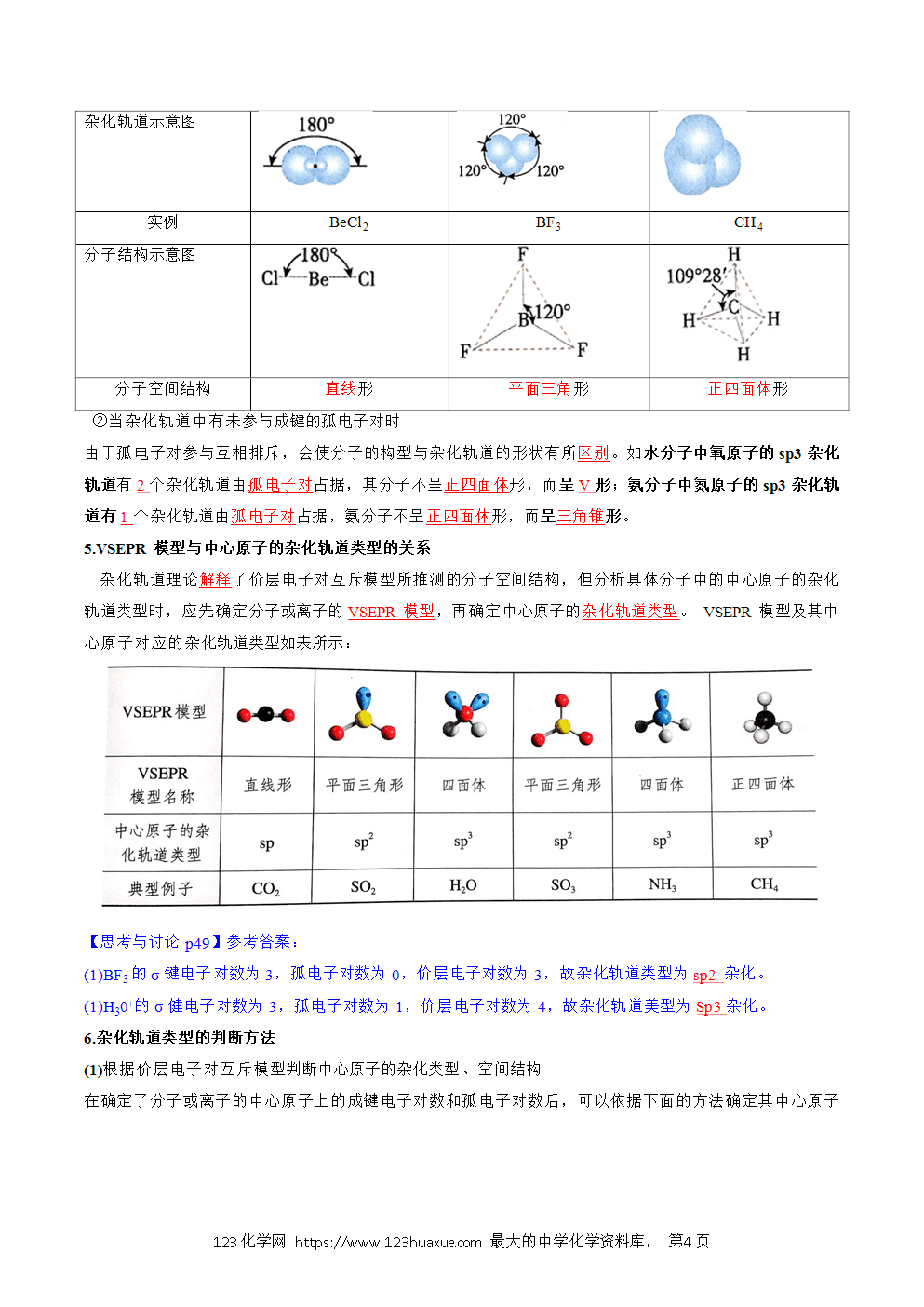
①杂化轨道数等于参与杂化的原子轨道数;
②杂化改变了原子轨道的形状和方向;
③杂化使原子的成键能力增强;
④杂化轨道用于构建分子的σ轨道和孤电子对轨道。
2.杂化轨道理论的要点
(1)原子形成分子时,通常存在激发、杂化和轨道重叠等过程。发生轨道杂化的原子一定是中心原子。
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子不可能发生杂化。
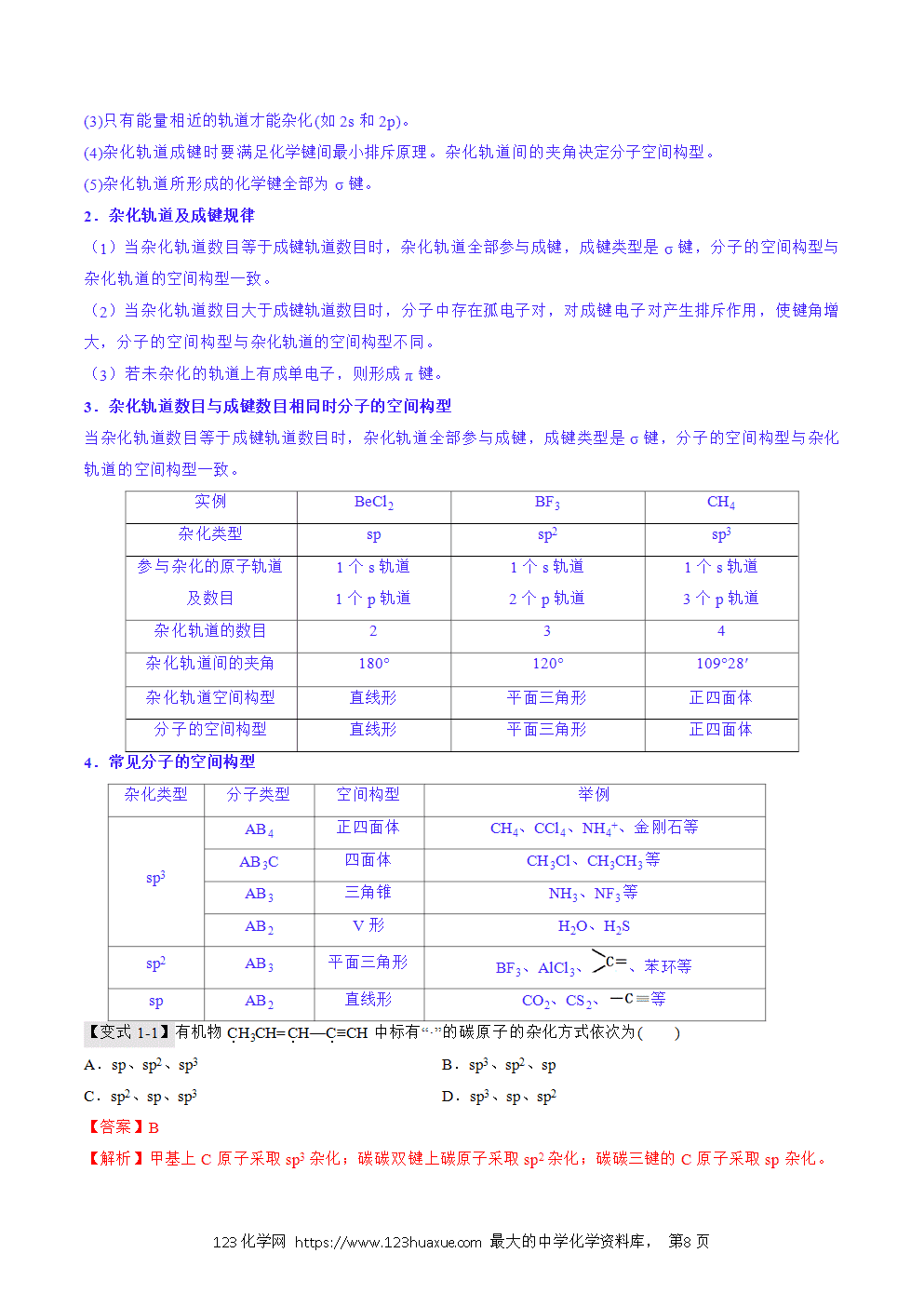
(3)只有能量相近的原子轨道才能杂化(如2s、2p)。
(4)杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同。
(5)为使相互间的排斥力最小,杂化轨道在空间取最大夹角分布。杂化后轨道的伸展方向、形状发生改变,但相同杂化形式的杂化轨道形状完全相同。杂化使原子的成键能力增加。形成的共价键更牢固。
(6)杂化轨道用于形成σ键或者用来容纳未参与成键的孤电子对。未参与杂化的p轨道可用于形成π键。分子的空间结构主要取决于原子轨道的杂化类型。
(7)杂化轨道成键时仍具有共价键的特征——方向性和饱和性
(8)杂化轨道数=中心原子上的孤电子对数+与中心原子结合的原子数。