第一章 物质及其变化
第三节 氧化还原反应
第1课时 氧化还原反应
【教学目标】
1.通过日常生活中常见的氧化还原反应引入课堂内容,理解氧化还原反应、氧化反应和还原反应的概念,掌握根据反应中元素的化合价是否发生变化来判断氧化还原反应和非氧化还原反应,培养学生证据推理与模型认知的化学核心素养。
2.能够用电子转移的观点判断、分析氧化还原反应,培养学生宏观辨识与微观探析的化学核心素养。
3.能够应用所学知识解释生产和生活中对人类有益的氧化还原反应,能利用所学知识避开氧化还原反应对人类的有害影响,培养学生科学态度与社会责任的化学核心素养。
【教学重难点】
重点:1.从不同角度对氧化还原反应进行理解。
2.理解氧化还原反应的概念。
3.理解四大反应类型与氧化还原反应的关系。
难点:氧化还原反应的本质。
【教学过程】
一、情景导入
在初中阶段,我们学过氧化反应和还原反应,什么是氧化反应,什么是还原反应?
【学生】有氧气参与的反应是氧化反应,失去氧的反应是还原反应。
二、新课讲授
【思考与交流】请分析下列2个氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。
2CuO + C === 2Cu + CO2↑
H2O + C === H2 + CO
【师】从得氧、失氧的分析:
结论:氧化还原反应是反应过程中有氧得失的化学反应
【思考与交流】若是从化合价的角度分析该如何呢?
【学生】物质所含元素化合价升高的反应是氧化反应,物质所含元素化合价降低的反应是还原反应
【师】一、氧化还原反应的基本概念
可见,从化合价升降角度不但可以分析有得氧失氧的化学反应,也可以分析没有得氧失氧的化学反应,扩大了概念的适用范围
【学生】结论:氧化还原反应是反应过程中有元素化合物升降的化学反应
【师】特征:元素化合价升降(判断依据)。
总结:通过以上分析可以看出,物质所含元素化合价升高的反应是氧化反应,物质所含元素化合价降低的反应是还原反应。
【师】那么我们再看一下面的反应:Fe + CuSO4 == FeSO4 + Cu。在这个反应中有得氧失氧吗?元素的化合价有变化吗?
【学生】没有得氧失氧;铁元素的化合价由反应前的0价变为+2;铜元素的化合价由反应前的+2价变为0价。
【总结】此反应中没有得氧失氧的情况,但是物质中所含元素的化合价发生了变化,这个反应就是氧化还原反应。因此,我们判断一个反应是不是氧化还原反应应该从化合价有没有发生变化来判断,而不要再用得氧失氧来判断。
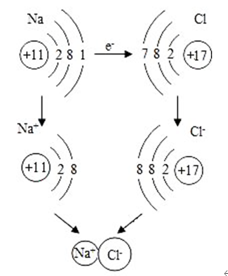
【思考与交流】化合价的升降是什么原因引起的?
【师】二、氧化还原反应的本质
氧化还原反应中,粒子间发生重新组合,元素的化合价发生变化,必然与原子结构有密切的联系,那么这种联系是什么呢?要深刻地揭示氧化还原反应的本质,还需要从微观的角度来进一步认识电子转移与氧化还原的关系。