






(1)通过分析酸、碱、盐之间的反应事实,认识离子反应,归纳离子反应发生的条件。
(2)正确书写这些反应的离子方程式。
(3)通过实验了解常见离子的检验方法,进一步理解离子反应。
【内容分析】
在学习电离和电离方程式的基础上,教材通过实验1-3的现象和分析,得出Na2SO4稀溶液与BaCl2稀溶液反应的微观实质,从而引出离子反应和离子方程式,并介绍离子方程式的书写步骤。然后,教材以“思考与讨论”的形式,得出中和反应的实质,引导学生深人认识离子反应。最后,教材说明酸、碱、盐在水溶液中发生复分解反应的微观实质,并总结这类离子反应发生的条件等。
本节内容的特点是概念多、抽象,理论性强。在呈现方式上,教材-方面紧密结合实验引人概念,充分发挥实验在化学概念形成中的重要功能,如现象直观、易懂,有利于激发学习兴趣等;另一方面注重基于实验证据(宏观现象)进行分析和推理,逐步引导学生认识物质导电性及电解质在溶液中反应的本质特征(微观实质),建立电离与离子反应的概念模型,体会模型在解释化学现象、揭示现象的本质中所发挥的重要作用,发展化学学科核心素养。
【教学重点和难点】
重点:离子方程式的书写。
难点:电解质概念,离子反应发生的条件
【教学流程】
【学习任务一】温故知新,发现问题
电解质溶于水后,电离成为自由移动的离子。这些离子之间是否一定会发生反应?
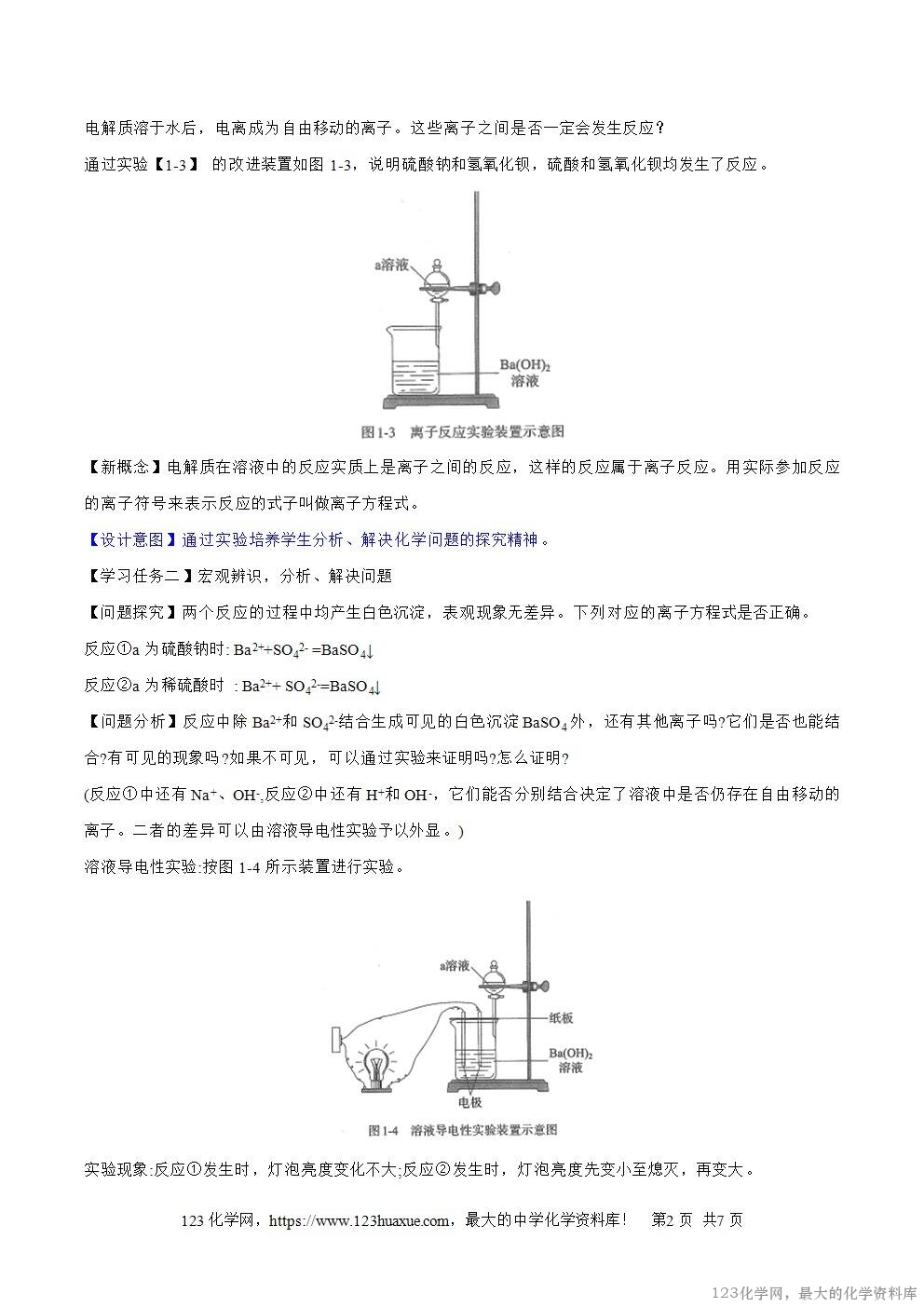
通过实验【1-3】 的改进装置如图1-3,说明硫酸钠和氢氧化钡,硫酸和氢氧化钡均发生了反应。
【新概念】电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。用实际参加反应的离子符号来表示反应的式子叫做离子方程式。
【设计意图】通过实验培养学生分析、解决化学问题的探究精神。
【学习任务二】宏观辨识,分析、解决问题
【问题探究】两个反应的过程中均产生白色沉淀,表观现象无差异。下列对应的离子方程式是否正确。
反应①a为硫酸钠时: Ba2++SO42- =BaSO4↓
反应②a为稀硫酸时 : Ba2++ SO42-=BaSO4↓
【问题分析】反应中除Ba2+和SO42-结合生成可见的白色沉淀BaSO4外,还有其他离子吗?它们是否也能结合?有可见的现象吗?如果不可见,可以通过实验来证明吗?怎么证明?
(反应①中还有Na+、OH-,反应②中还有H+和OH-,它们能否分别结合决定了溶液中是否仍存在自由移动的离子。二者的差异可以由溶液导电性实验予以外显。)
溶液导电性实验:按图1-4所示装置进行实验。
实验现象:反应①发生时,灯泡亮度变化不大;反应②发生时,灯泡亮度先变小至熄灭,再变大。
【设计意图】提出挑战性问题引发科学探究,实现深度学习在离子反应概念建立初期,宜使用伴有沉淀生成等明显现象的反应。为了让学生更深人地理解离子反应概念,可以给出更具挑战性的问题,引发科学探究过程。
【学习任务三】微观辨析,探究问题根源
【思考】如何正确书写上述两个实验的离子方程式,离子方程式的书写步骤是怎样的?
【学生活动】思考讨论,形成书写离子方程式的思维模板。
【思考与讨论】完成下表中各反应的化学方程式和离子方程式,思考两种方程式在表示某一类反应时,表达的含义有什么不同,并进行讨论。