

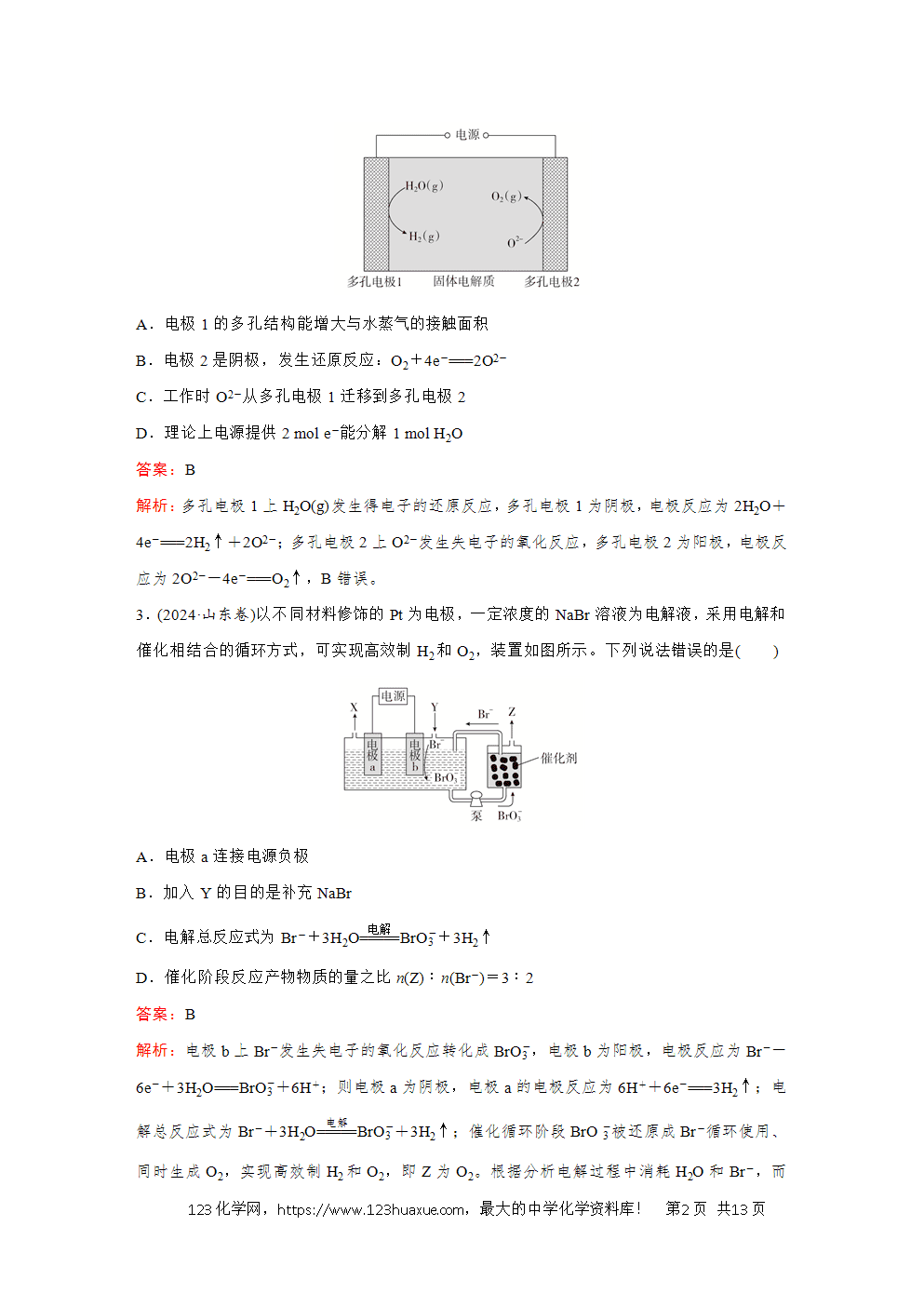






1.(2024·辽宁卷)“绿色零碳”氢能前景广阔。为解决传统电解水制“绿氢”阳极电势高、反应速率缓慢的问题,科技工作者设计耦合HCHO高效制H2的方法,装置如图所示。部分反应机理为:
下列说法错误的是( )
A.相同电量下H2理论产量是传统电解水的1.5倍
B.阴极反应:2H2O+2e-===2OH-+H2↑
C.电解时OH-通过阴离子交换膜向b极方向移动
D.阳极反应:2HCHO-2e-+4OH-===2HCOO-+2H2O+H2↑
答案:A
解析:据图示可知,b电极上HCHO转化为HCOO-,而HCHO转化为HCOO-为氧化反应,所以b电极为阳极,a电极为阴极,HCHO为阳极反应物,由反应机理 可知阳极反应:①HCHO+OH--e-―→HCOOH+2(1)H2,②HCOOH+OH-===HCOO-+H2O,阴极反应为2H2O-2e-===H2↑+2OH-。由以上分析可知,转移2 mol电子时,阴、阳两极各生成1 mol H2,共2 mol H2,而传统电解水:2H2O电解(=====)2H2↑+O2↑,转移2 mol电子,只有阴极生成1 mol H2,所以相同电量下H2理论产量是传统电解水的2倍,A错误。
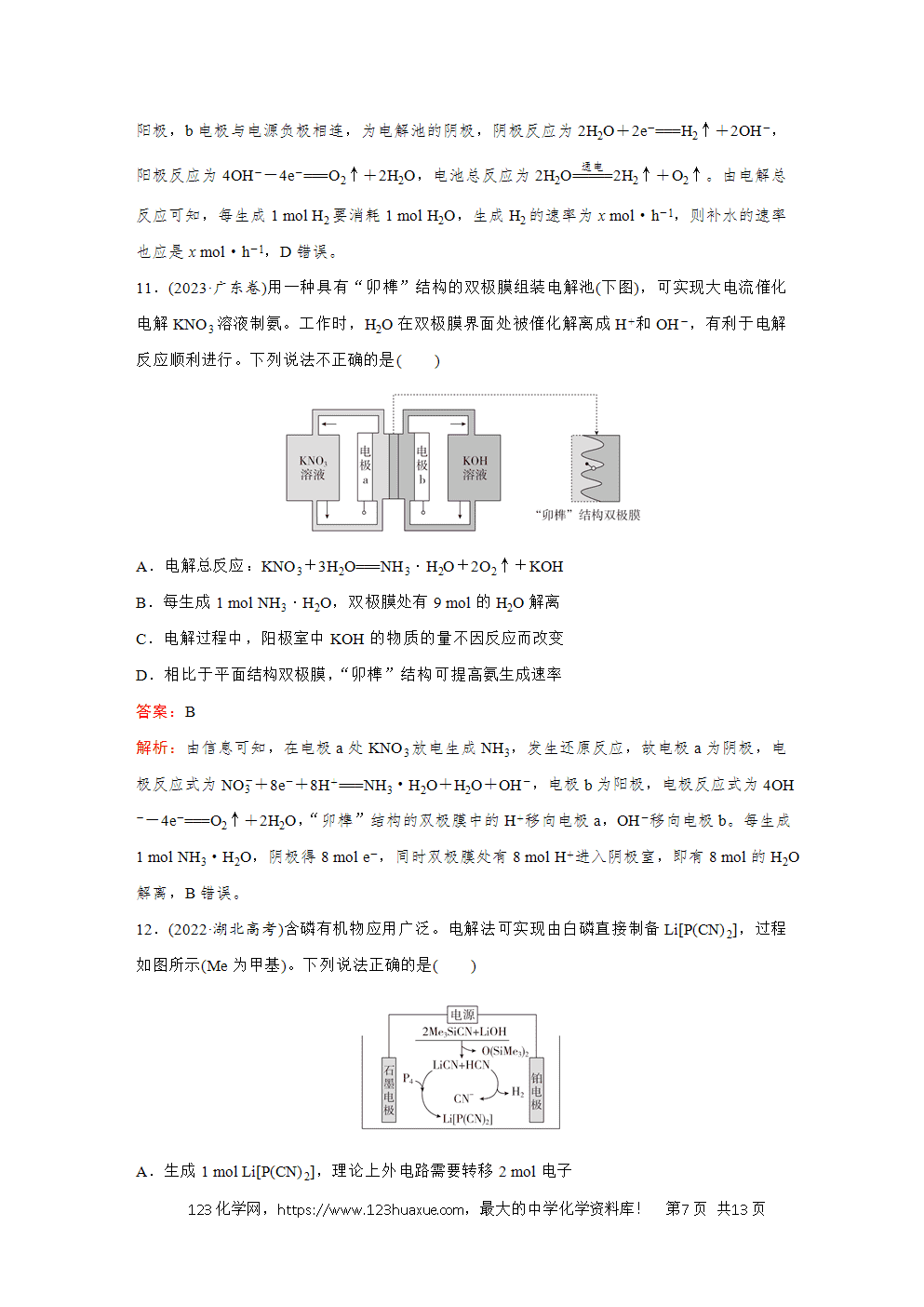
2.(2024·甘肃卷)某固体电解池工作原理如图所示,下列说法错误的是( )
A.电极1的多孔结构能增大与水蒸气的接触面积
B.电极2是阴极,发生还原反应:O2+4e-===2O2-
C.工作时O2-从多孔电极1迁移到多孔电极2
D.理论上电源提供2 mol e-能分解1 mol H2O
答案:B
解析:多孔电极1上H2O(g)发生得电子的还原反应,多孔电极1为阴极,电极反应为2H2O+4e-===2H2↑+2O2-;多孔电极2上O2-发生失电子的氧化反应,多孔电极2为阳极,电极反应为2O2--4e-===O2↑,B错误。
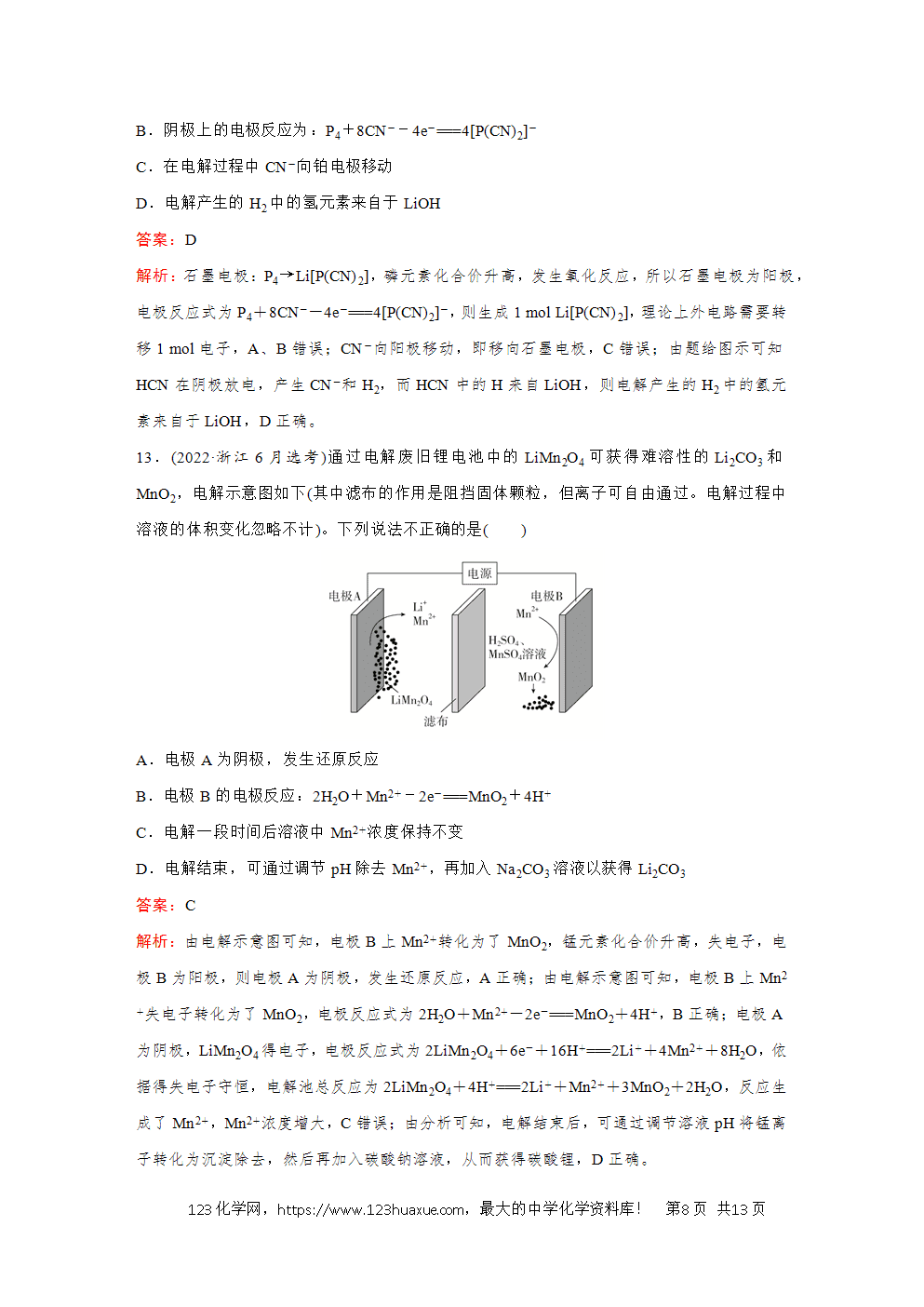
3.(2024·山东卷)以不同材料修饰的Pt为电极,一定浓度的NaBr溶液为电解液,采用电解和催化相结合的循环方式,可实现高效制H2和O2,装置如图所示。下列说法错误的是( )
A.电极a连接电源负极
B.加入Y的目的是补充NaBr
C.电解总反应式为Br-+3H2O电解(=====)BrO3(-)+3H2↑
D.催化阶段反应产物物质的量之比n(Z)∶n(Br-)=3∶2
答案:B
解析:电极b上Br-发生失电子的氧化反应转化成BrO3(-),电极b为阳极,电极反应为Br--6e-+3H2O===BrO3(-)+6H+;则电极a为阴极,电极a的电极反应为6H++6e-===3H2↑;电解总反应式为Br-+3H2O电解(=====)BrO3(-)+3H2↑;催化循环阶段BrO3(-)被还原成Br-循环使用、同时生成O2,实现高效制H2和O2,即Z为O2。根据分析电解过程中消耗H2O和Br-,而催化阶段BrO3(-)被还原成Br-循环使用,故加入Y的目的是补充H2O,维持NaBr溶液为一定浓度,B错误。