


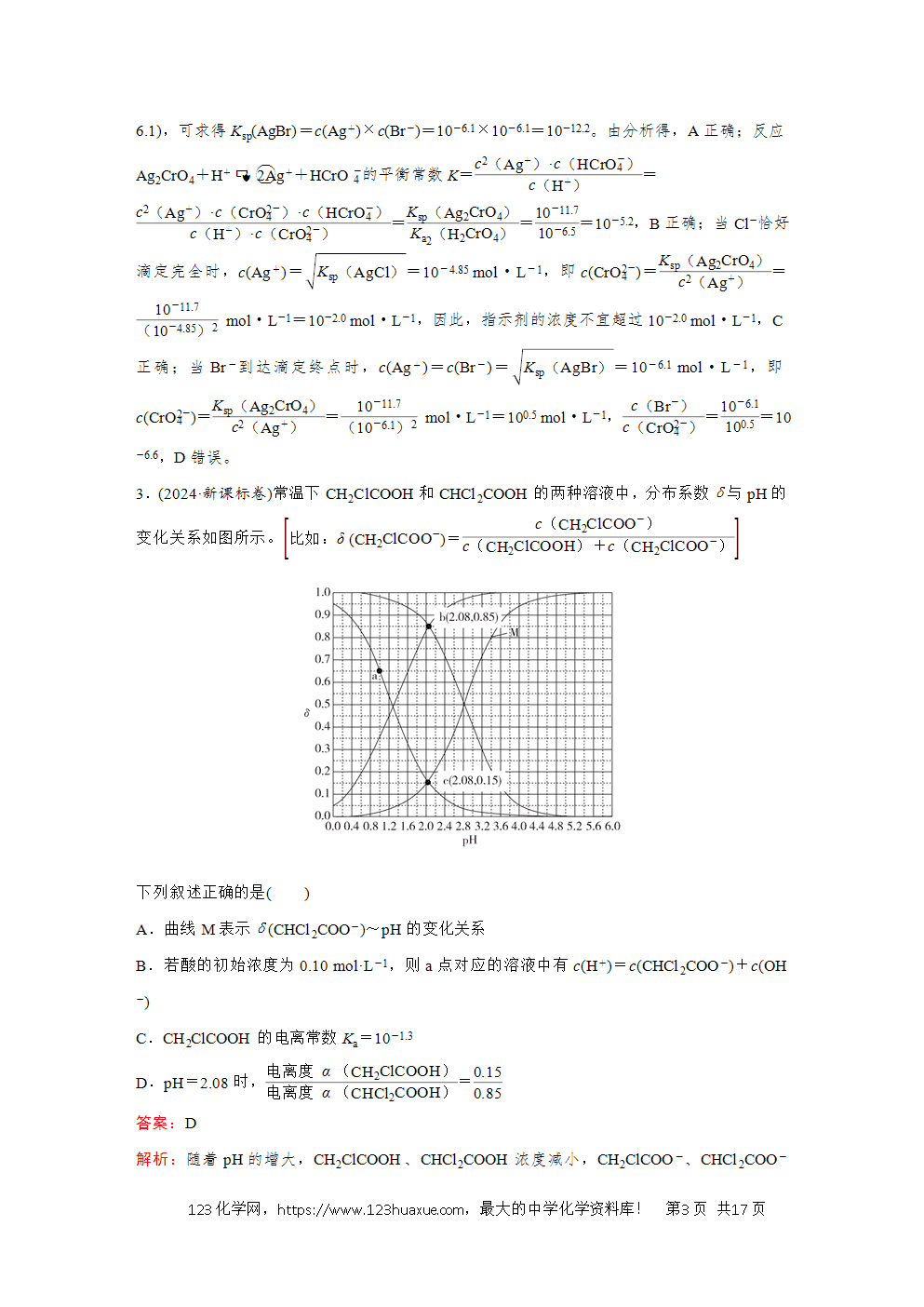










1.(2024·全国甲卷)将0.10 mmol Ag2CrO4配制成1.0 mL悬浊液,向其中滴加0.10 mol·L-1的NaCl溶液。lg [cM/(mol·L-1)](M代表Ag+、Cl-或CrO4(2-))随加入NaCl溶液体积(V)的变化关系如图所示。
下列叙述正确的是( )
A.交点a处:c(Na+)=2c(Cl-)
B.Ksp(Ag2CrO4)(Ksp(AgCl))=10-2.21
C.V≤2.0 mL时,4(2-)c(Cl-)())不变
D.y1=-7.82,y2=-lg 34
答案:D
解析:向1.0 mL含0.10 mmol Ag2CrO4的悬浊液中滴加0.10 mol·L-1的NaCl溶液,发生反应:Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO4(2-)(aq),两者恰好完全反应时,NaCl溶液的体积为V(NaCl)=0.10 mol·L-1(2×0.10×10-3 mol)=2×10-3 L=2 mL,2 mL之后再加NaCl溶液,c(Cl-)增大,据AgCl(s)Ag+(aq)+Cl-(aq),Ksp(AgCl)=c(Ag+)·c(Cl-)可知,c(Ag+)会随着c(Cl-)增大而减小,所以2 mL后降低的曲线,即最下方的虚线代表lg c(Ag+)随V(NaCl)的变化曲线,则中间的曲线代表lg c(Cl-)随V(NaCl)的变化曲线,则最上方的实线为lg c(CrO4(2-))随V(NaCl)的变化曲线。2 mL时Ag2CrO4与NaCl溶液恰好完全反应,则a点时溶质为NaCl和Na2CrO4,电荷守恒:c(Na+)+c(Ag+)+c(H+)=2c(CrO4(2-))+c(Cl-)+c(OH-),此时c(H+)、c(OH-)、c(Ag+)可忽略不计,a点为Cl-和CrO4(2-)曲线的交点,即c(CrO4(2-))=c(Cl-),则溶液中c(Na+)≈3c(Cl-),A错误;当V(NaCl)=1.0 mL时,有一半的Ag2CrO4转化为AgCl,Ag2CrO4与AgCl共存,均达到沉淀溶解平衡,取图中横坐标为1.0 mL的点,得Ksp(AgCl)=c(Ag+)·c(Cl-)=10-5.18×10-4.57=10-9.75,Ksp(Ag2CrO4)=c2(Ag+)·c(CrO4(2-))=(10-5.18)2×10-1.60=10-11.96,则Ksp(Ag2CrO4)(Ksp(AgCl))=10-11.96(10-9.75)=102.21,B错误;V<2.0 mL时,Ag+未沉淀完全,体系中Ag2CrO4和AgCl共存,则Ksp(Ag2CrO4)(Ksp(AgCl))=4(2-))(2-)为定值,即4(2-)c(Cl-)())为定值,由图可知,在V≤2.0 mL时c(Ag+)并不是定值,则4(2-)c(Cl-)())的值也不是定值,即在变化,C错误;V>2.0 mL时,AgCl处于饱和状态,V(NaCl)=2.4 mL时,图像显示c(Cl-)=10-1.93 mol·L-1,则c(Ag+)=c(Cl-)(Ksp(AgCl))=10-1.93(10-9.75) mol·L-1=10-7.82 mol·L-1,故y1=-7.82,此时Ag2CrO4全部转化为AgCl,n(CrO4(2-))守恒,等于起始时n(Ag2CrO4),则c(CrO4(2-))=4(2-)V())=(1+2.4)×10-3 L(0.1×10-3 mol)=34(1) mol·L-1,则y2=lg c(CrO4(2-))=lg 34(1)=-lg 34,D正确。
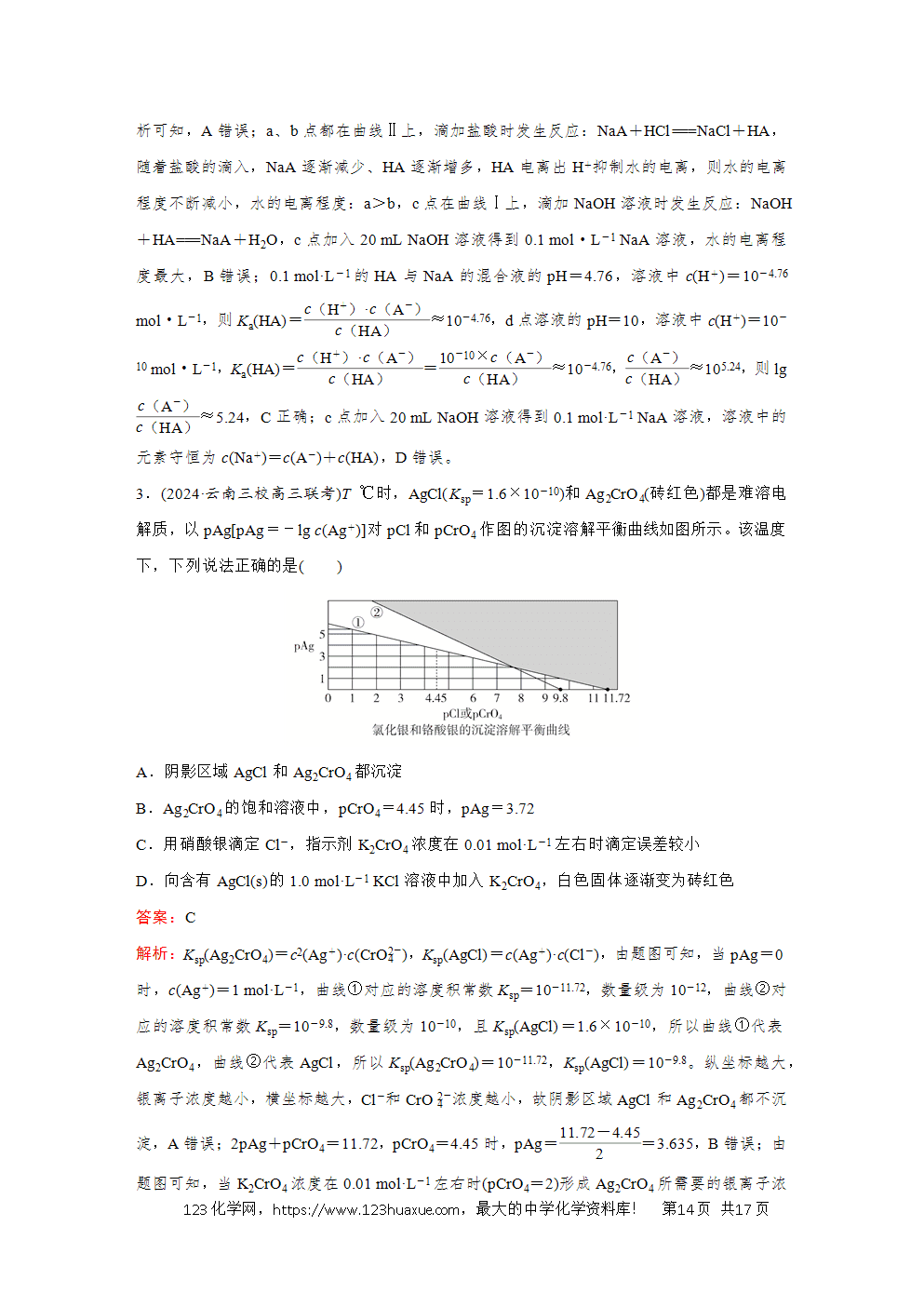
2.(2024·辽宁卷)25 ℃下,AgCl、AgBr和Ag2CrO4的沉淀溶解平衡曲线如下图所示。某实验小组以K2CrO4为指示剂,用AgNO3标准溶液分别滴定含Cl-水样、含Br-水样。
已知:①Ag2CrO4为砖红色沉淀;②相同条件下AgCl溶解度大于AgBr;③25 ℃时,pKa1 (H2CrO4)=0.7,pKa2(H2CrO4)=6.5。
下列说法错误的是( )
A.曲线②为AgCl沉淀溶解平衡曲线
B.反应Ag2CrO4+H+2Ag++HCrO4(-)的平衡常数K=10-5.2
C.滴定Cl-时,理论上混合液中指示剂浓度不宜超过10-2.0 mol·L-1
D.滴定Br-达终点时,溶液中4(2-))(2-)=10-0.5
答案:D
解析:由于AgCl和AgBr中阴、阳离子个数比均为1∶1,即两者图像平行,所以①代表Ag2CrO4的沉淀溶解平衡曲线,由于相同条件下,AgCl溶解度大于AgBr,即Ksp(AgCl)>Ksp(Ag