




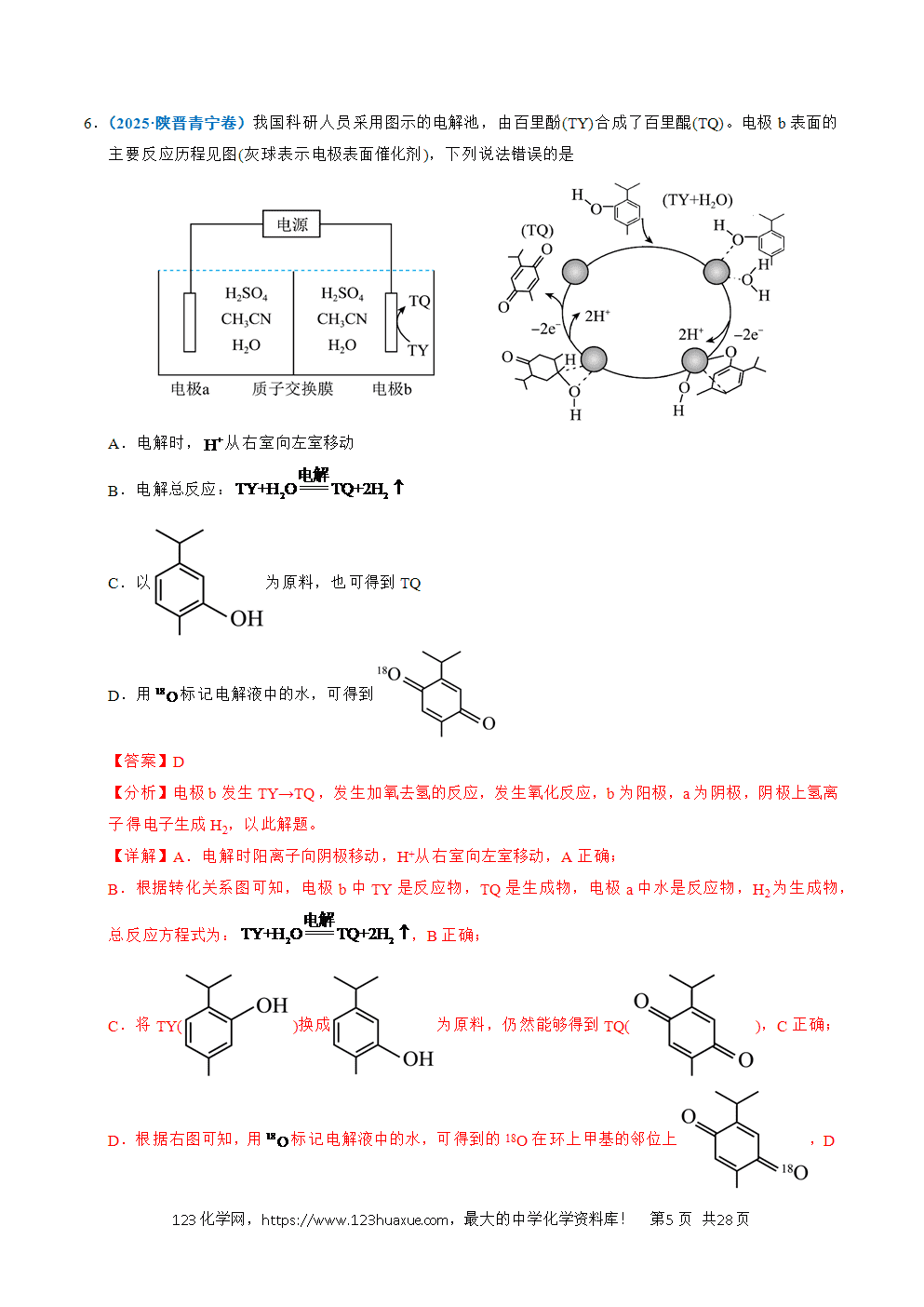


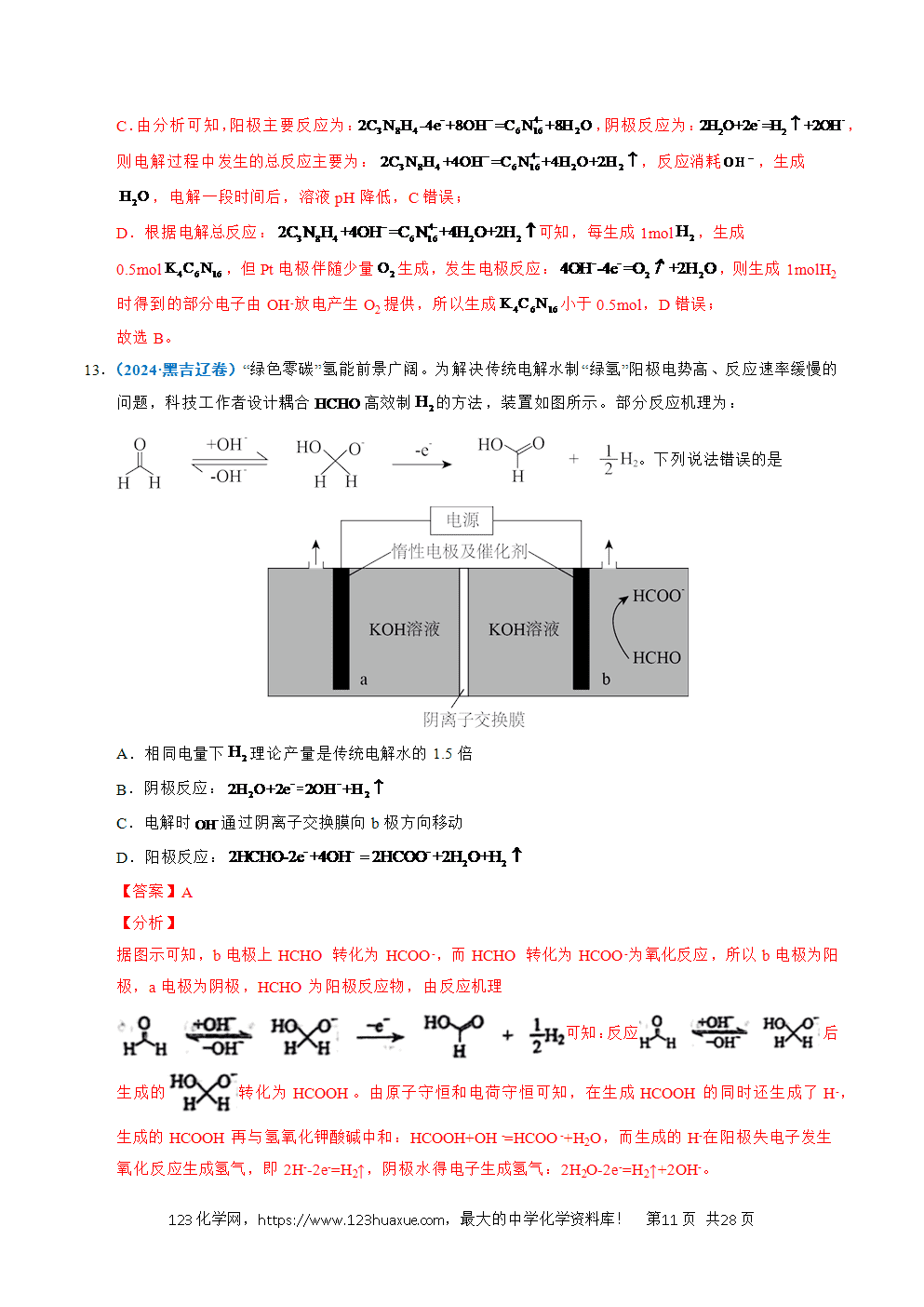
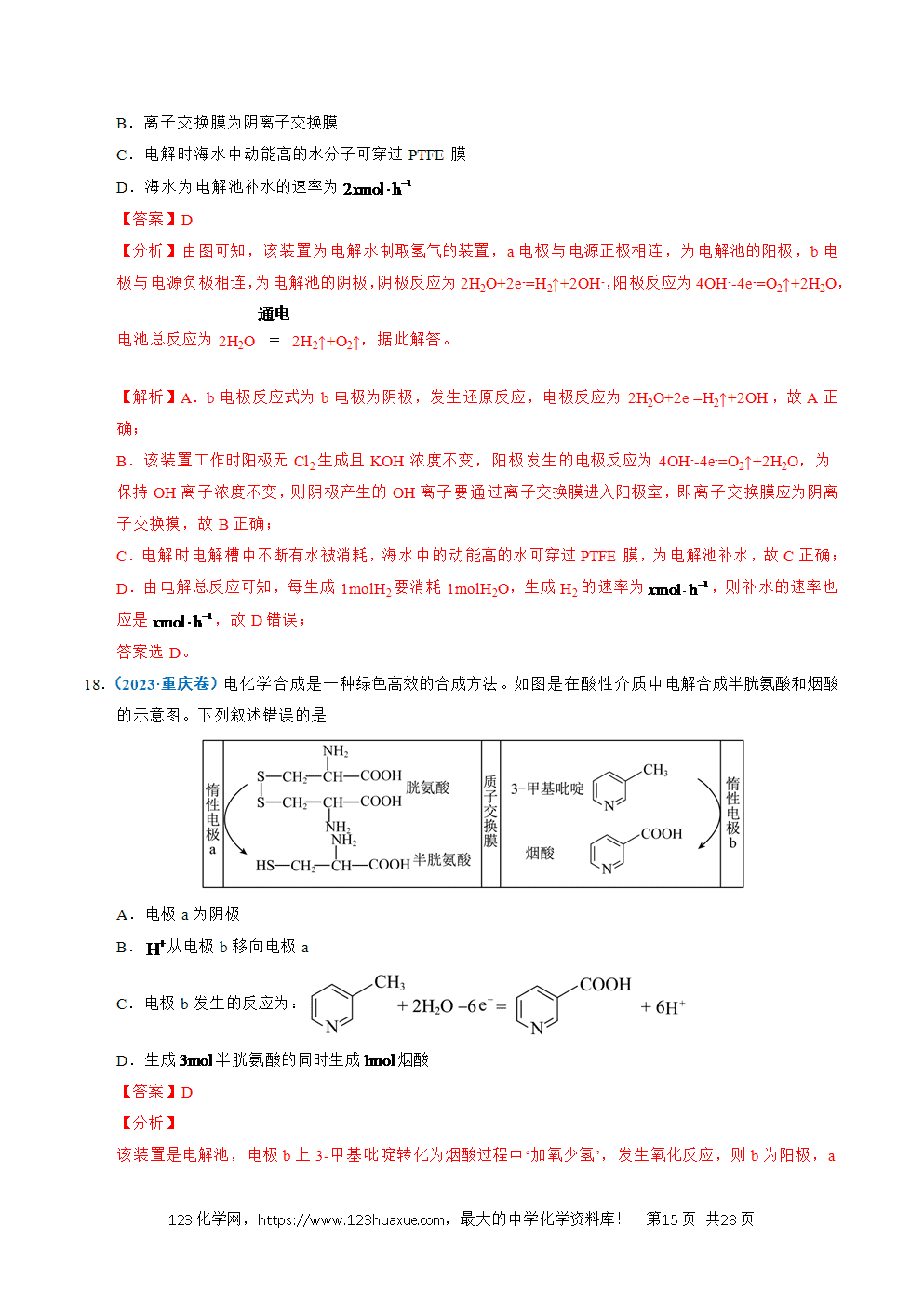




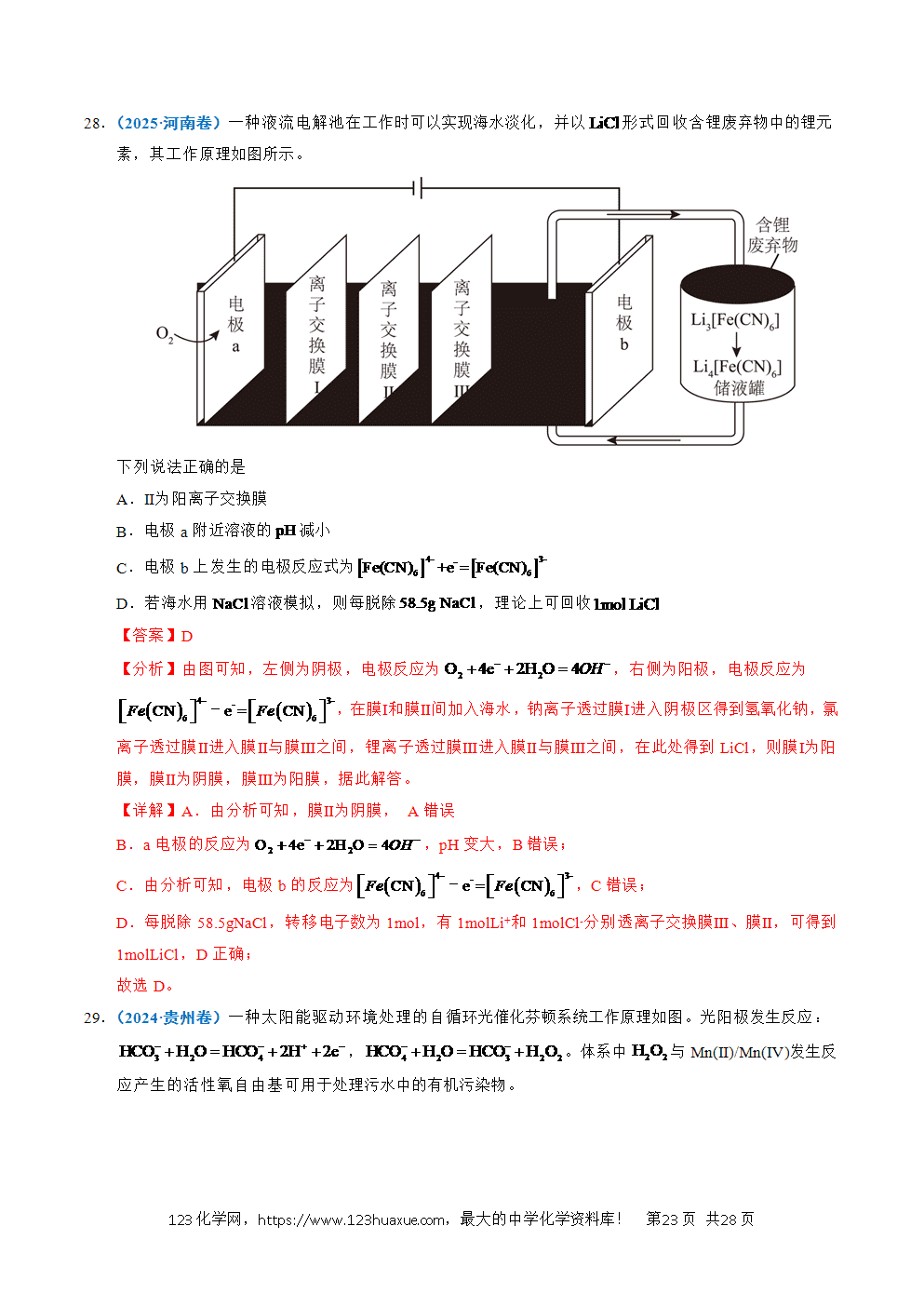

1.(2025·江苏卷)以稀为电解质溶液的光解水装置如图所示,总反应为。下列说法正确的是
A.电极a上发生氧化反应生成
B.通过质子交换膜从右室移向左室
C.光解前后,溶液的不变
D.外电路每通过电子,电极b上产生
【答案】A
【分析】光解过程中,电极a上电子流出,发生氧化反应,a为负极,电极反应式为:;电极b上电子流入,发生还原反应,b为正极,电极反应式为:。
【详解】A.根据分析,电极a为负极,发生氧化反应,电极反应式为:,生成物有O2,A正确;
B.原电池中阳离子向正极移动,电极a上生成,电极b上消耗,通过质子交换膜从左室移向右室,B错误;
C.在探究溶液浓度变化时,不仅要关注溶质的变化,也要关注溶剂的变化,在光解总反应是电解水,溶液中减少,溶液浓度增大,pH减小,C错误;
D.生成,转移2mol电子,外电路通过0.01mol电子时,电极b上生成,D错误;
答案选A。
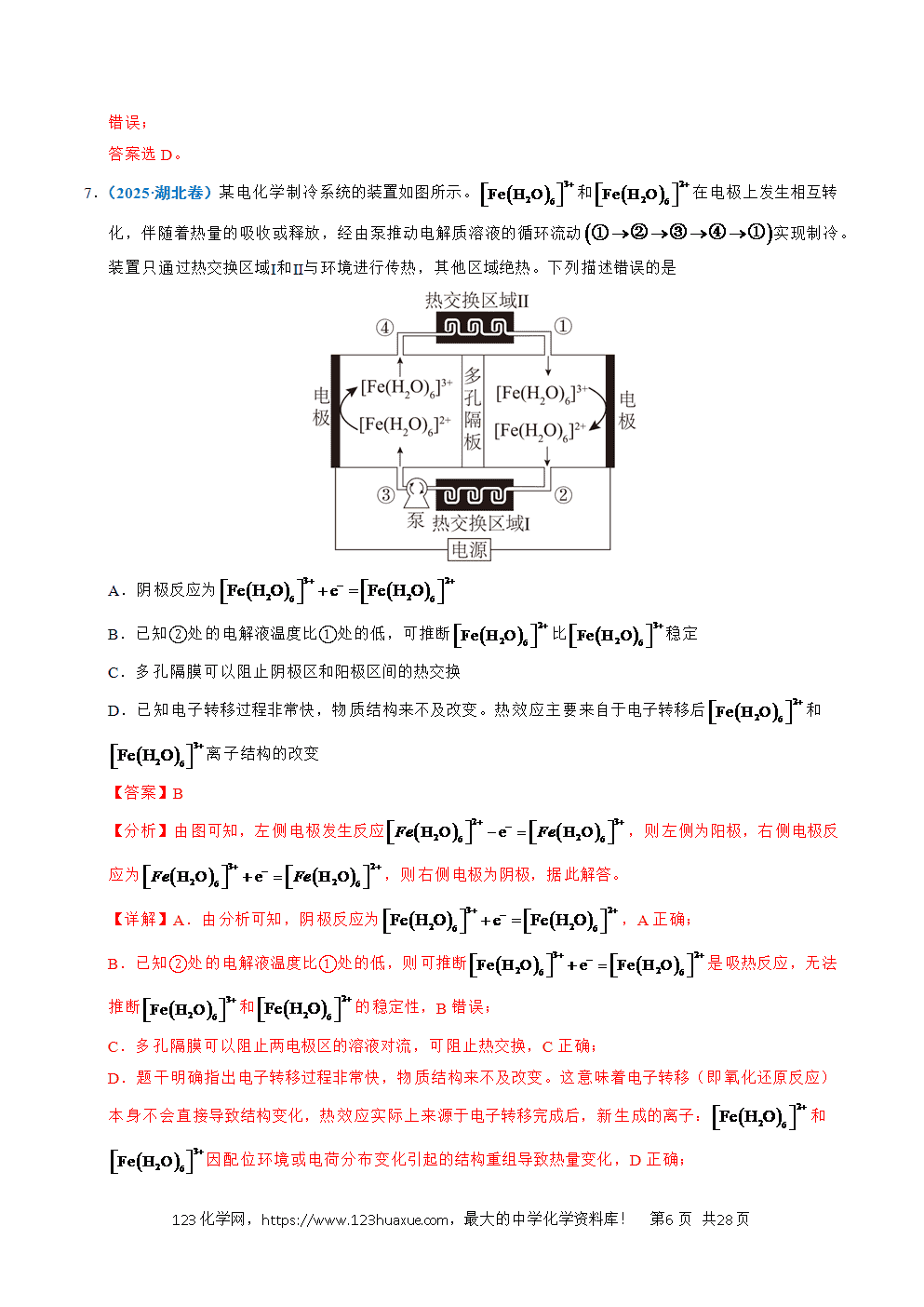
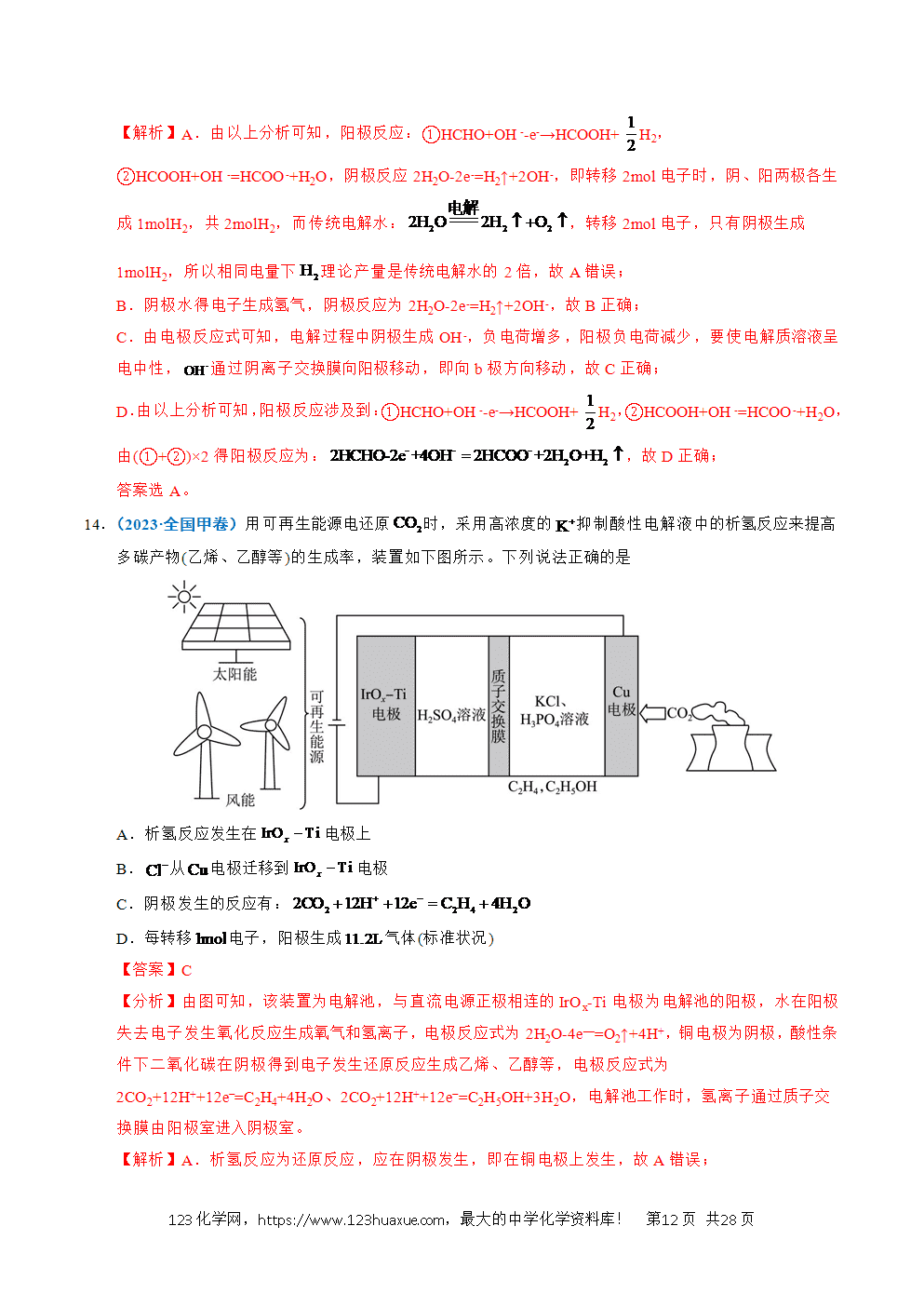
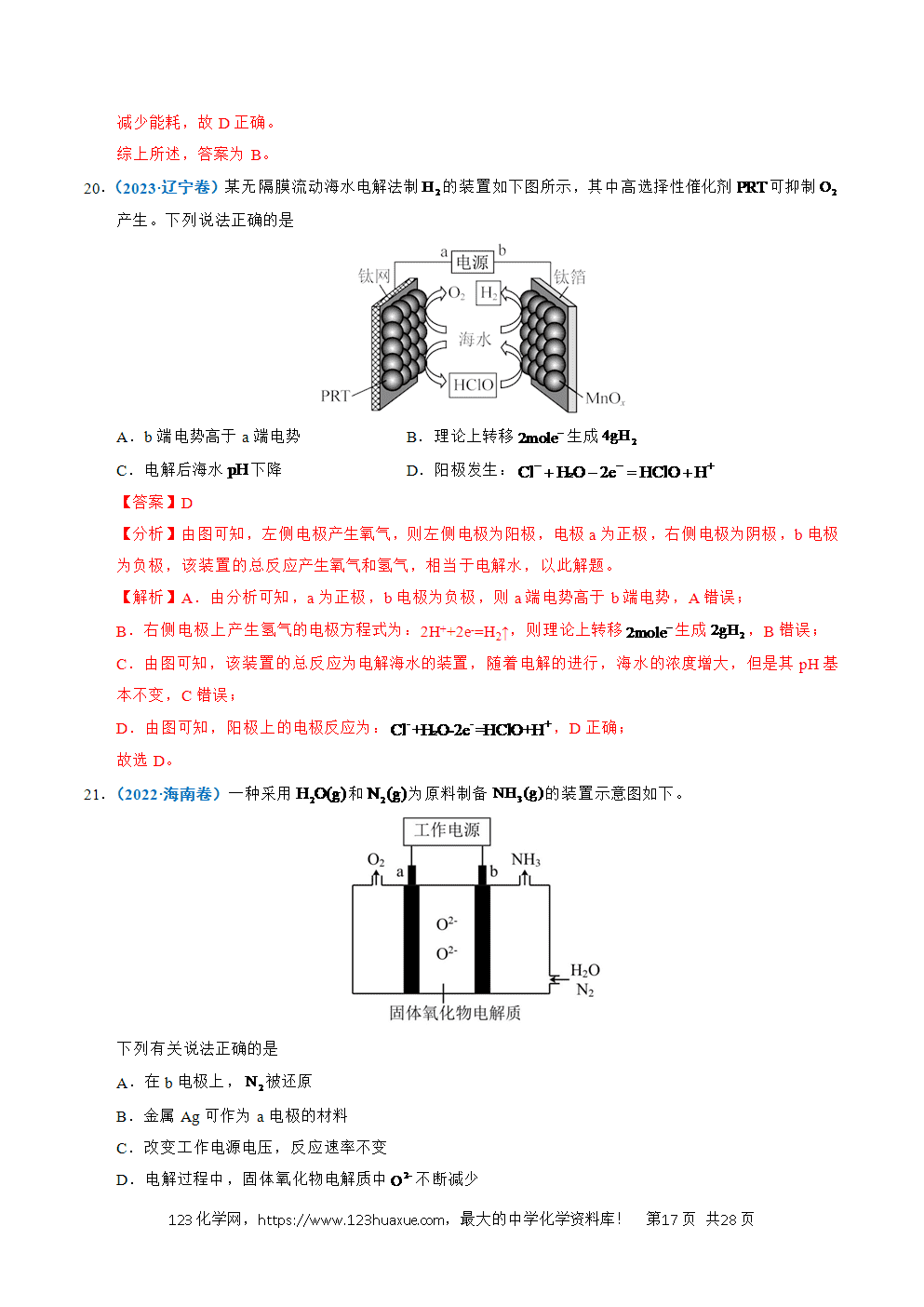
2.(2024·甘肃卷)某固体电解池工作原理如图所示,下列说法错误的是
A.电极1的多孔结构能增大与水蒸气的接触面积
B.电极2是阴极,发生还原反应:
C.工作时从多孔电极1迁移到多孔电极2
D.理论上电源提供能分解
【答案】B
【分析】多孔电极1上H2O(g)发生得电子的还原反应转化成H2(g),多孔电极1为阴极,电极反应为2H2O+4e-=2H2+2O2-;多孔电极2上O2-发生失电子的氧化反应转化成O2(g),多孔电极2为阳极,电极反应为2O2--4e-=O2。
【解析】A.电极1的多孔结构能增大电极的表面积,增大与水蒸气的接触面积,A项正确;
B.根据分析,电极2为阳极,发生氧化反应:2O2--4e-=O2,B项错误;
C.工作时,阴离子O2-向阳极移动,即O2-从多孔电极1迁移到多孔电极2,C项正确;
D.根据分析,电解总反应为2H2O(g)2H2+O2,分解2molH2O转移4mol电子,则理论上电源提供2mol电子能分解1molH2O,D项正确;
答案选B。
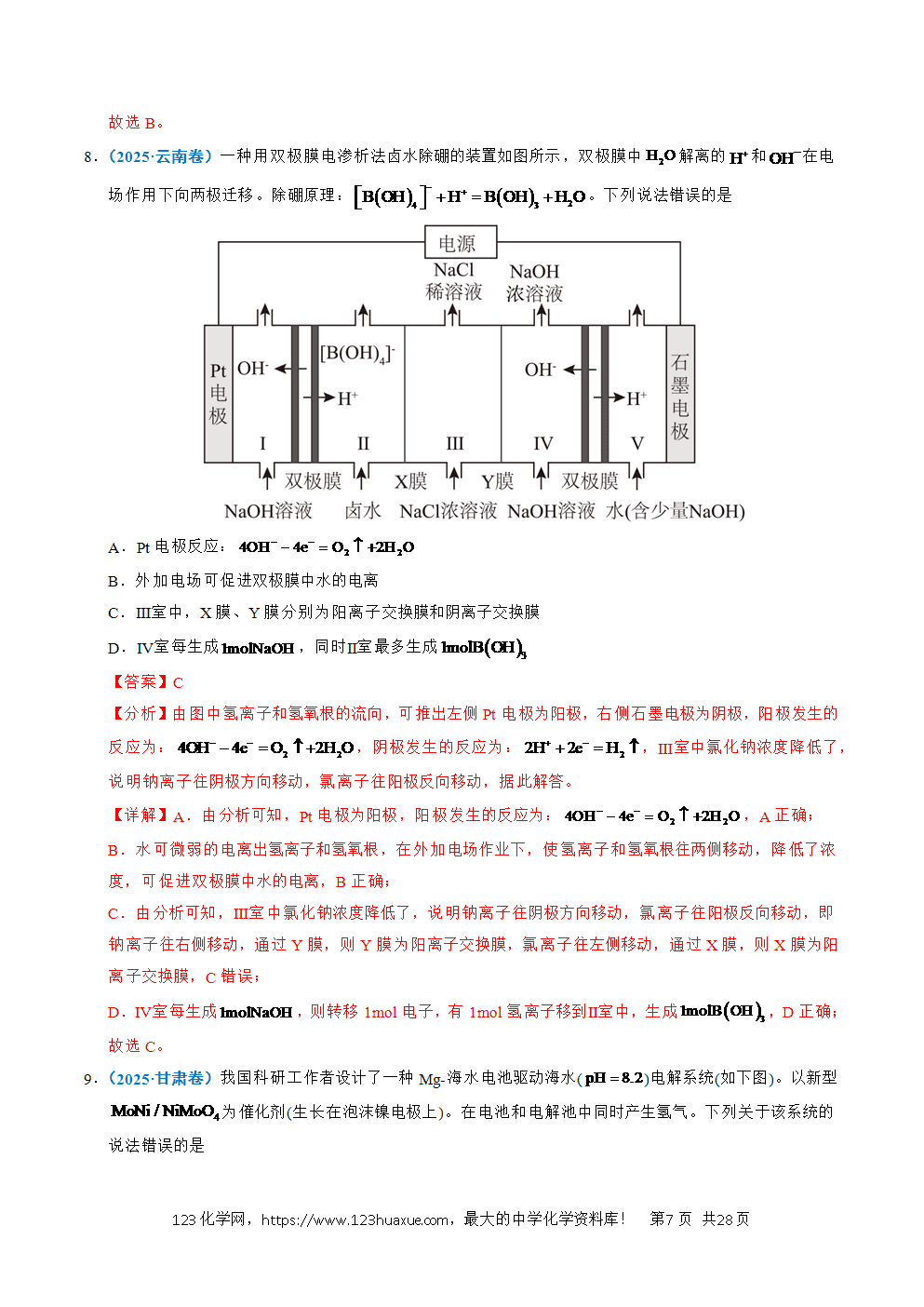
3.(2022·广东卷)以熔融盐为电解液,以含和等的铝合金废料为阳极进行电解,实现的再生。该过程中
A.阴极发生的反应为 B.阴极上被氧化
C.在电解槽底部产生含的阳极泥 D.阳极和阴极的质量变化相等
【答案】C
【解析】根据电解原理可知,电解池中阳极发生失电子的氧化反应,阴极发生得电子的还原反应,该题中以熔融盐为电解液,含和等的铝合金废料为阳极进行电解,通过控制一定的条件,从而可使阳极区Mg和Al发生失电子的氧化反应,分别生成Mg2+和Al3+,Cu和Si不参与反应,阴极区Al3+得电子生成Al单质,从而实现Al的再生,据此分析解答。
A.阴极应该发生得电子的还原反应,实际上Mg在阳极失电子生成Mg2+,A错误;
B.Al在阳极上被氧化生成Al3+,B错误;
C.阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;
D.因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据电子转移数守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误;
故选C。
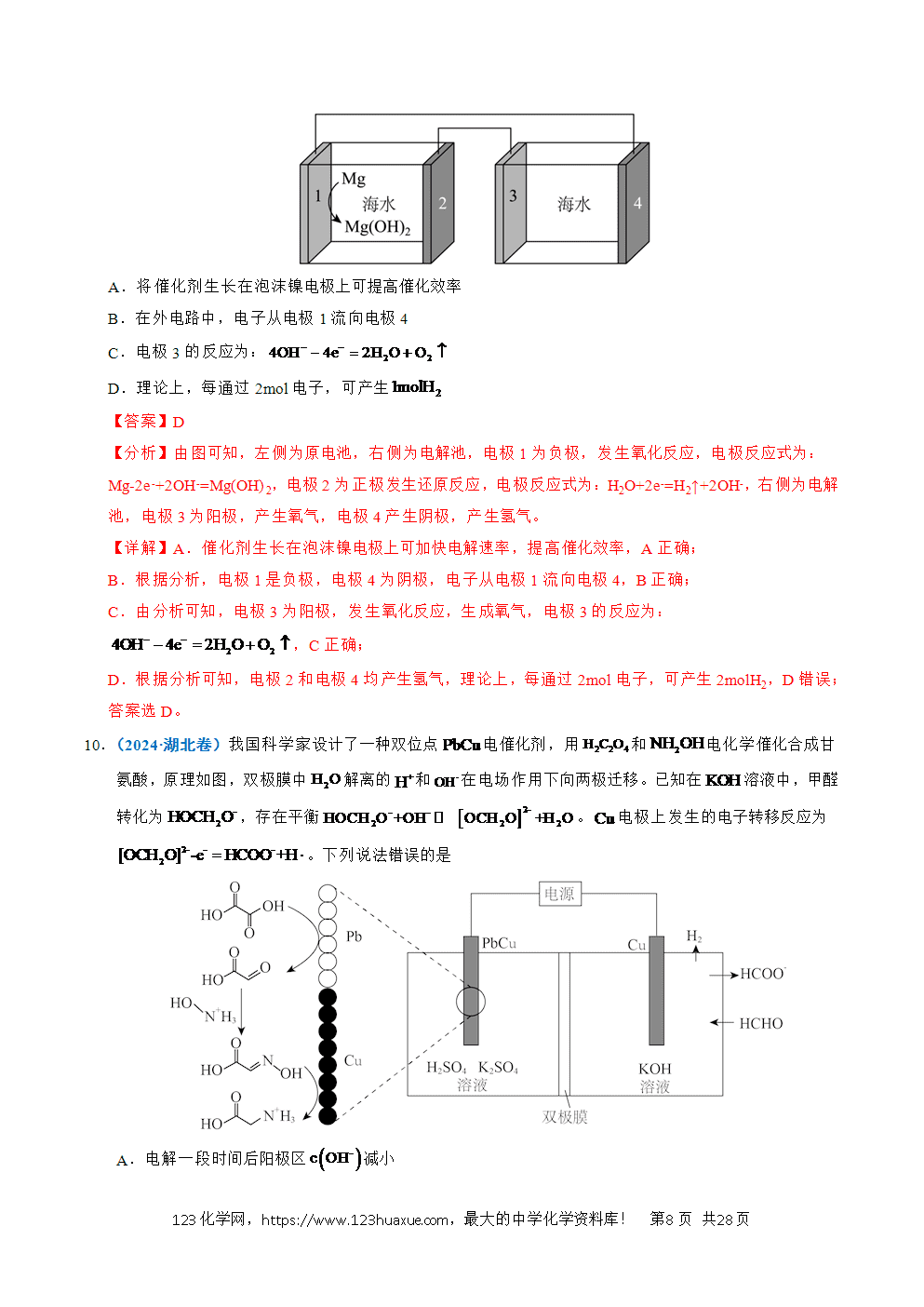
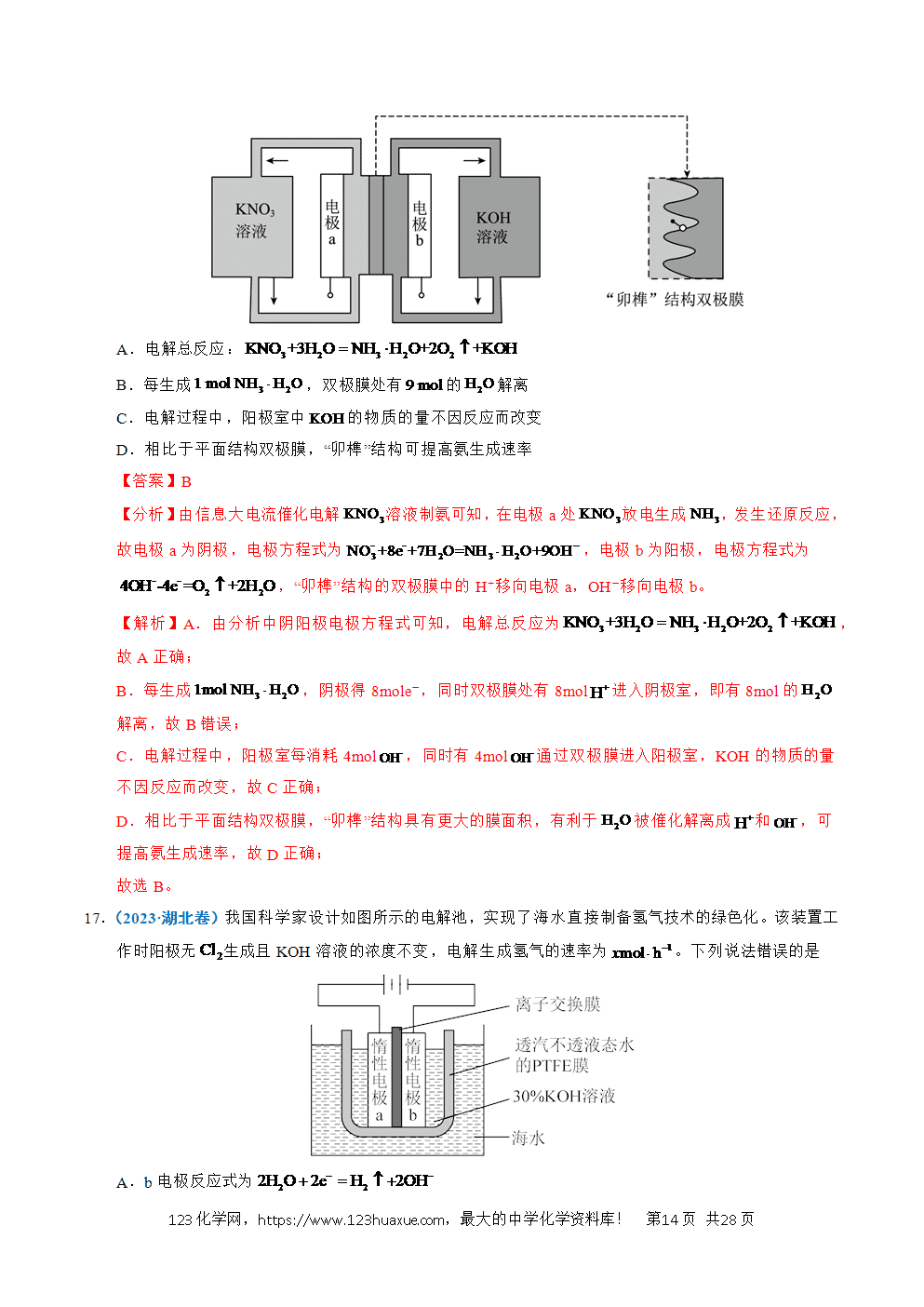
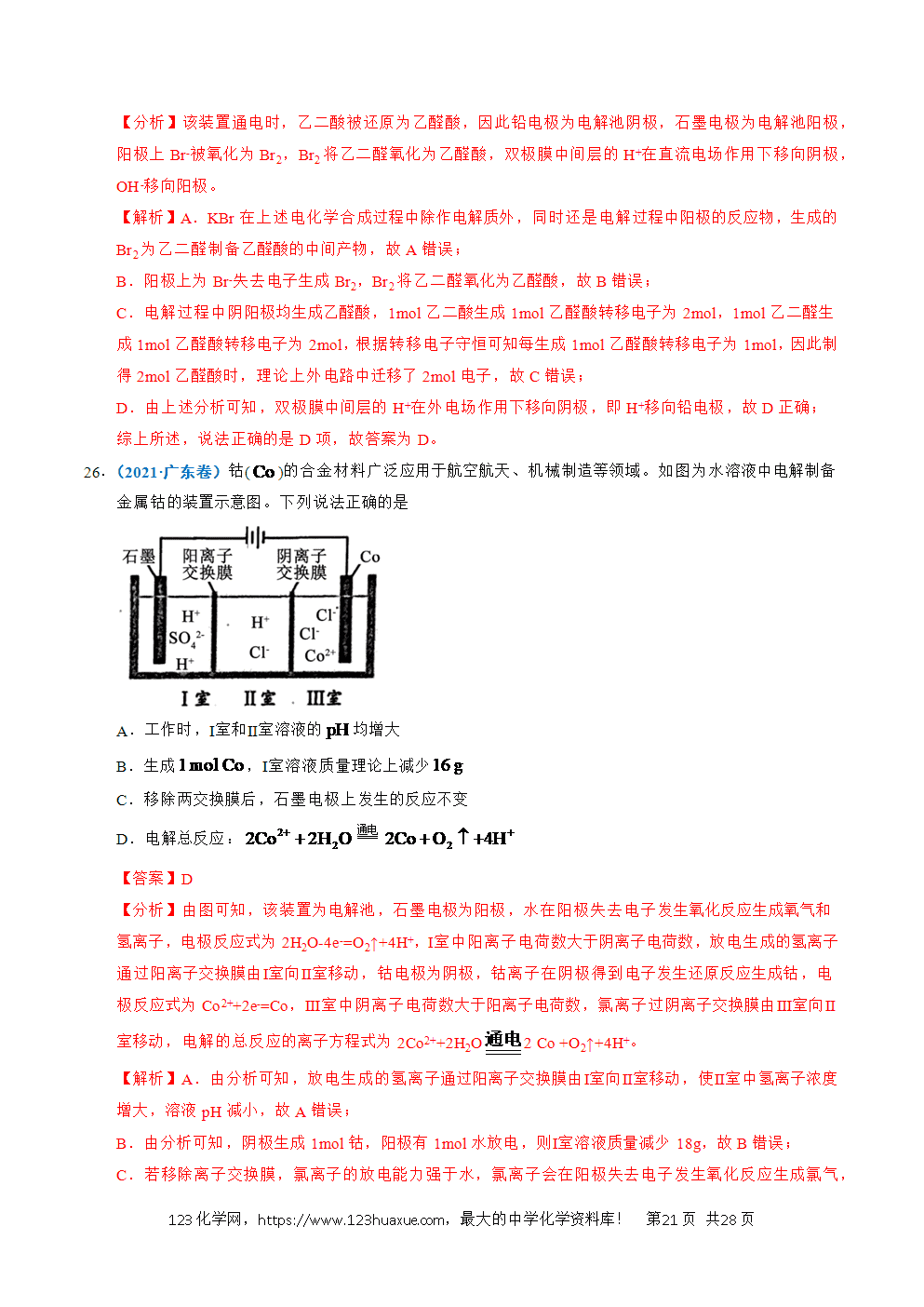
4.(2022·天津卷)实验装置如图所示。接通电源后,用碳棒(、)作笔,在浸有饱和NaCl溶液和石蕊溶液的湿润试纸上同时写字,端的字迹呈白色。下列结论正确的是
A.a为负极
B.端的字迹呈蓝色
C.电子流向为:
D.如果将、换成铜棒,与碳棒作电极时的现象相同
【答案】B
【解析】A.根据实验现象,a'端呈白色,即生成了氯气,即氯离子失去电子,为阳极,即a为正极,A错误;
B.b'端为阴极,水得到电子放电的同时,生成氢氧根离子,遇石蕊变蓝,B正确;
C.电子从电源的负极出来,即从a极出来,而不是b极,C错误;
D. 如果换成铜棒,铜做阳极放电,现象与碳作电极时不相同,D错误;
故选B。