


















1.(2025·浙江1月卷)磷是生命活动中不可或缺的元素。请回答:
(1)关于ⅤA族元素原子结构的描述,下列说法正确的是_______。
A.基态P原子轨道上的电子自旋方向相同 B.的最外层电子数为18
C.的半径小于的半径 D.电子排布为的P原子处于激发态
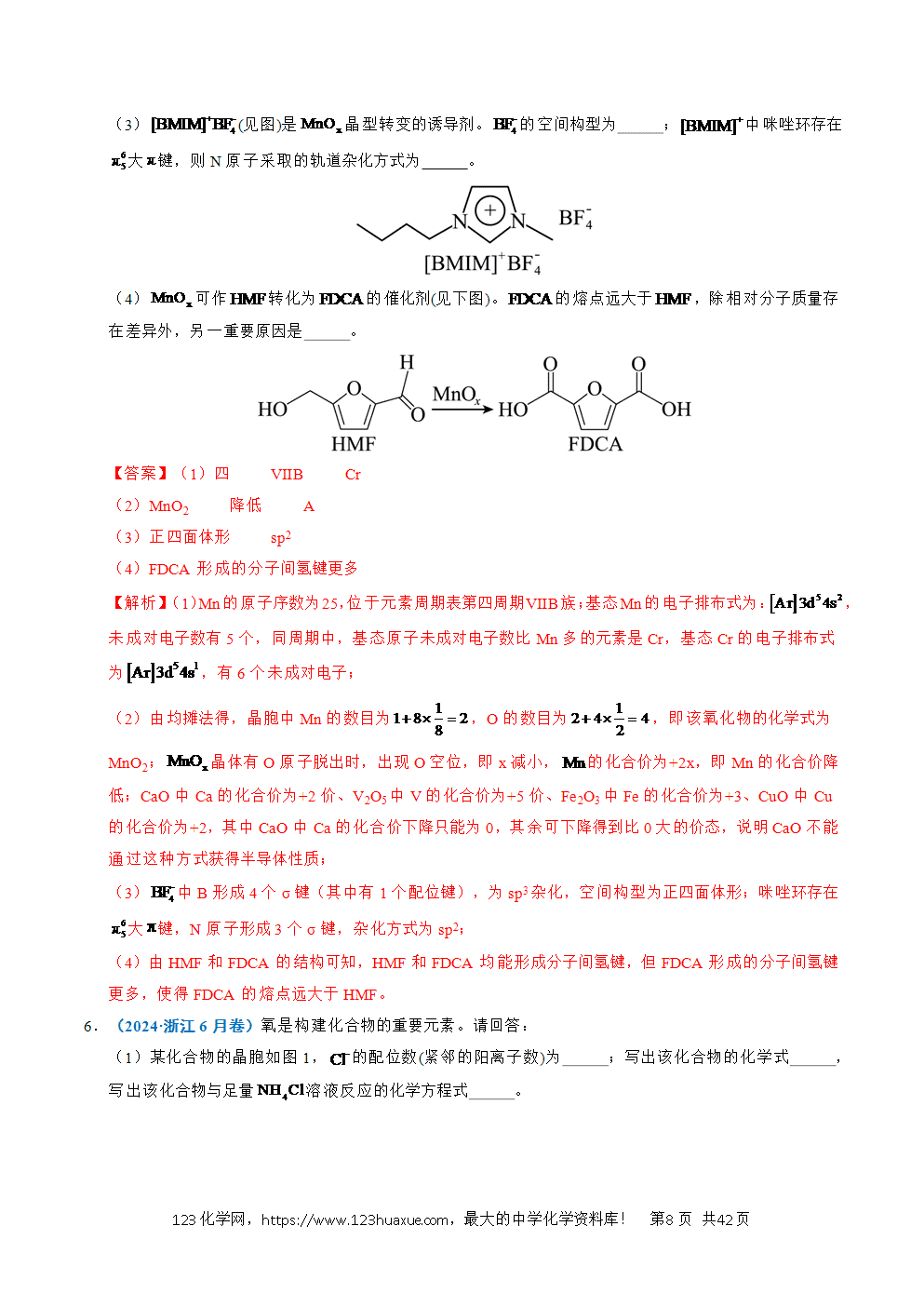
(2)某化合物的晶胞如图。
①化学式是 ;
②将该化合物加入到含少量石蕊的中,实验现象是 (从酸碱性和溶解性角度推测)。
(3)两分子脱水聚合得到一分子,从的结构角度分析差异的原因 。
(4)兴趣小组对某磷灰石[主要成分为和少量]进行探究,设计了两种制备的方法:
Ⅰ.用稍过量的浓与磷灰石反应,得到溶液、少量气体、渣(主要成分为)。
Ⅱ.将磷灰石脱水、还原,得到的白磷燃烧后与水反应制得溶液。
①方法I,所得溶液中含有的杂质酸是 。
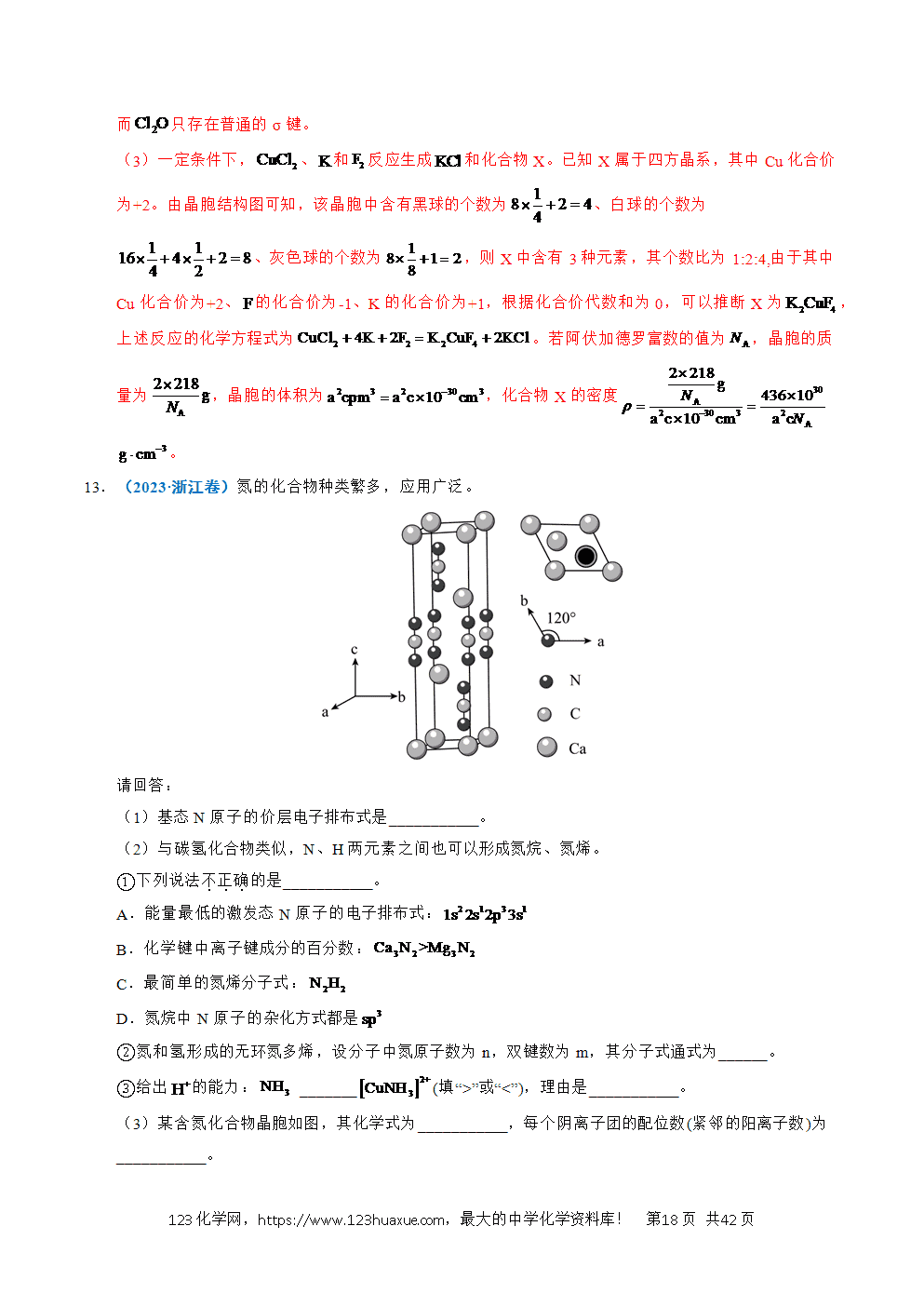
②以方法Ⅰ中所得渣为硫源,设计实验制备无水,流程如下:
溶液A是 ,系列操作B是 ,操作C是 。
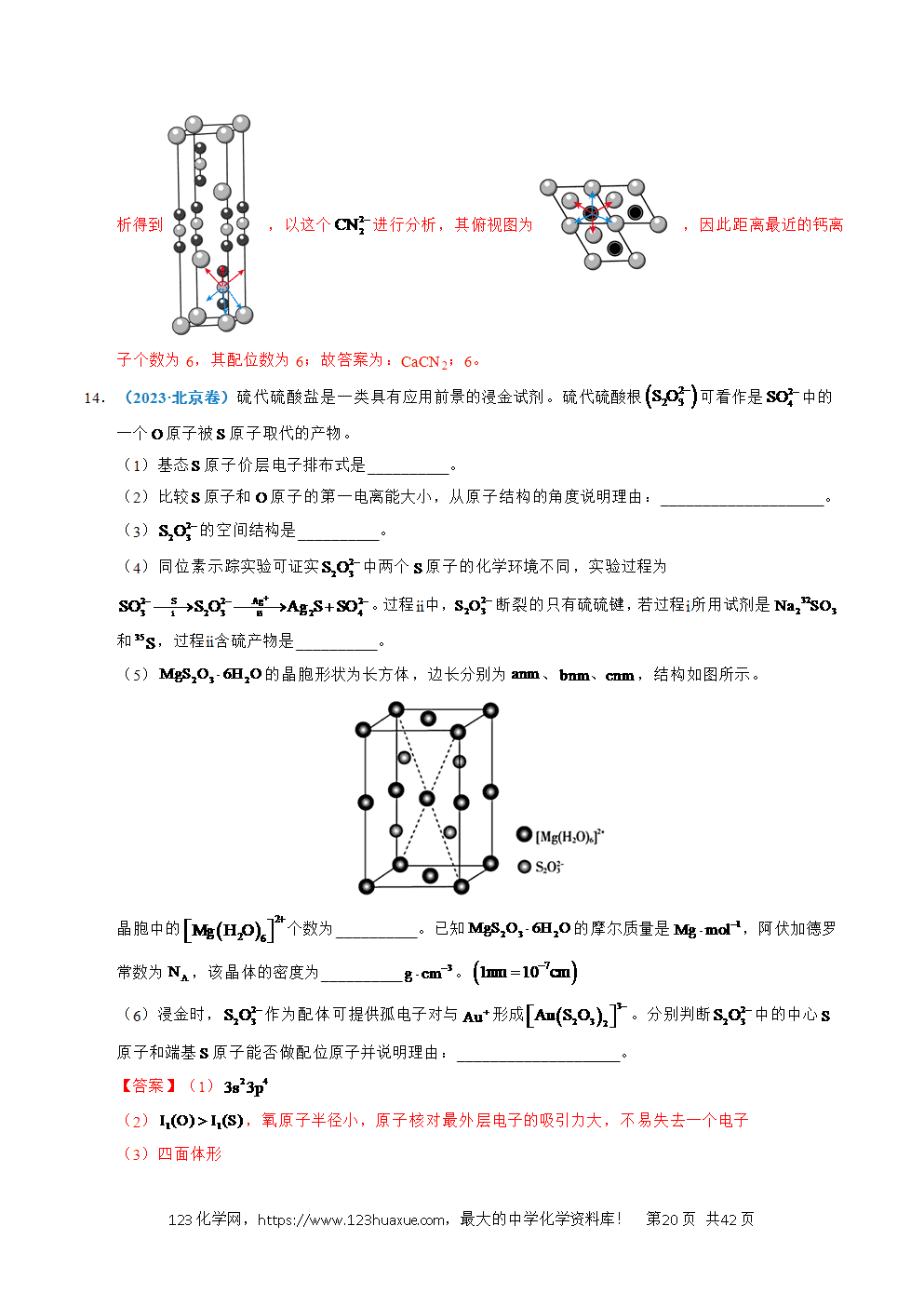
③方法Ⅱ中,脱水得到的(足量)与炭(C)、高温下反应,生成白磷和另一种可燃性气体,该反应的化学方程式是 。
【答案】(1)AD
(2)Ca3PCl3 溶液变蓝,有气体放出
(3)的负电荷密度大,更易结合氢离子
(4)硫酸、盐酸、氢氟酸 碳酸钠溶液 过滤、加硫酸、蒸发浓缩、冷却结晶、过滤、洗涤 加热脱水 2+30C+20SiO220CaSiO3+3P4+30CO↑
【解析】(1)A.基态P原子价电子排布式为3s23p3,根据洪特规则,轨道上的3个电子自旋方向相同,故A正确;
B.基态As原子价电子排布式为4s24p3,的价电子排布式为4s2,最外层电子数为2,故B错误;
C.比多一个电子层,所以的半径大于的半径,故C错误;
D.基态P原子的电子排布式为的,电子排布为的P原子处于激发态,故D正确;
选AD。
(2)①根据均摊原则,晶胞中Cl原子数、P原子数、Ca原子数,所以化学式是Ca3PCl3;
②Ca3PCl3中P显-3价,将该化合物加入到含少量石蕊的中,反应生成氯化钙、氢氧化钙、PH3气体,溶液呈碱性,实验现象是溶液变蓝,有气体放出。
(3)当两分子H3PO4脱水聚合时,结构发生变化,聚合结构的体积更大,负电荷分布更分散,更容易电离出氢离子,而的负电荷密度大,更易结合氢离子,所以聚合后的Ka3值增大;
(4)①方法I中,和浓硫酸反应生成硫酸钙、磷酸、氢氟酸、盐酸,氢氟酸和反应生成SiF4气体和水,所得溶液中含有的杂质酸是硫酸、盐酸、氢氟酸。
②碳酸钠和硫酸钙反应,硫酸钙转化为碳酸钙沉淀和硫酸钠,溶液A是碳酸钠溶液;过滤出碳酸钙,得硫酸钠、碳酸钠混合液,加硫酸除碳酸钠,蒸发浓缩、冷却结晶、过滤、洗涤得,系列操作B是过滤、加硫酸、蒸发浓缩、冷却结晶、过滤、洗涤,加热脱水得无水硫酸钠,操作C是加热脱水。
③方法Ⅱ中,脱水得到的(足量)与炭(C)、高温下反应,生成白磷和另一种可燃性气体,根据元素守恒,可燃性气体为CO,该反应的化学方程式是2+30C+20SiO2 20CaSiO3+3P4+30CO↑。
2.(2025·山东卷)单质及其化合物应用广泛。回答下列问题:
(1)在元素周期表中,位于第 周期 族。基态原子与基态离子未成对电子数之比为 。
(2)尿素分子与形成配离子的硝酸盐俗称尿素铁,既可作铁肥,又可作缓释氮肥。
①元素C、N、O中,第一电离能最大的是 ,电负性最大的是 。
②尿素分子中,C原子采取的轨道杂化方式为 。
③八面体配离子中的配位数为6,碳氮键的键长均相等,则与配位的原子是 (填元素符号)。
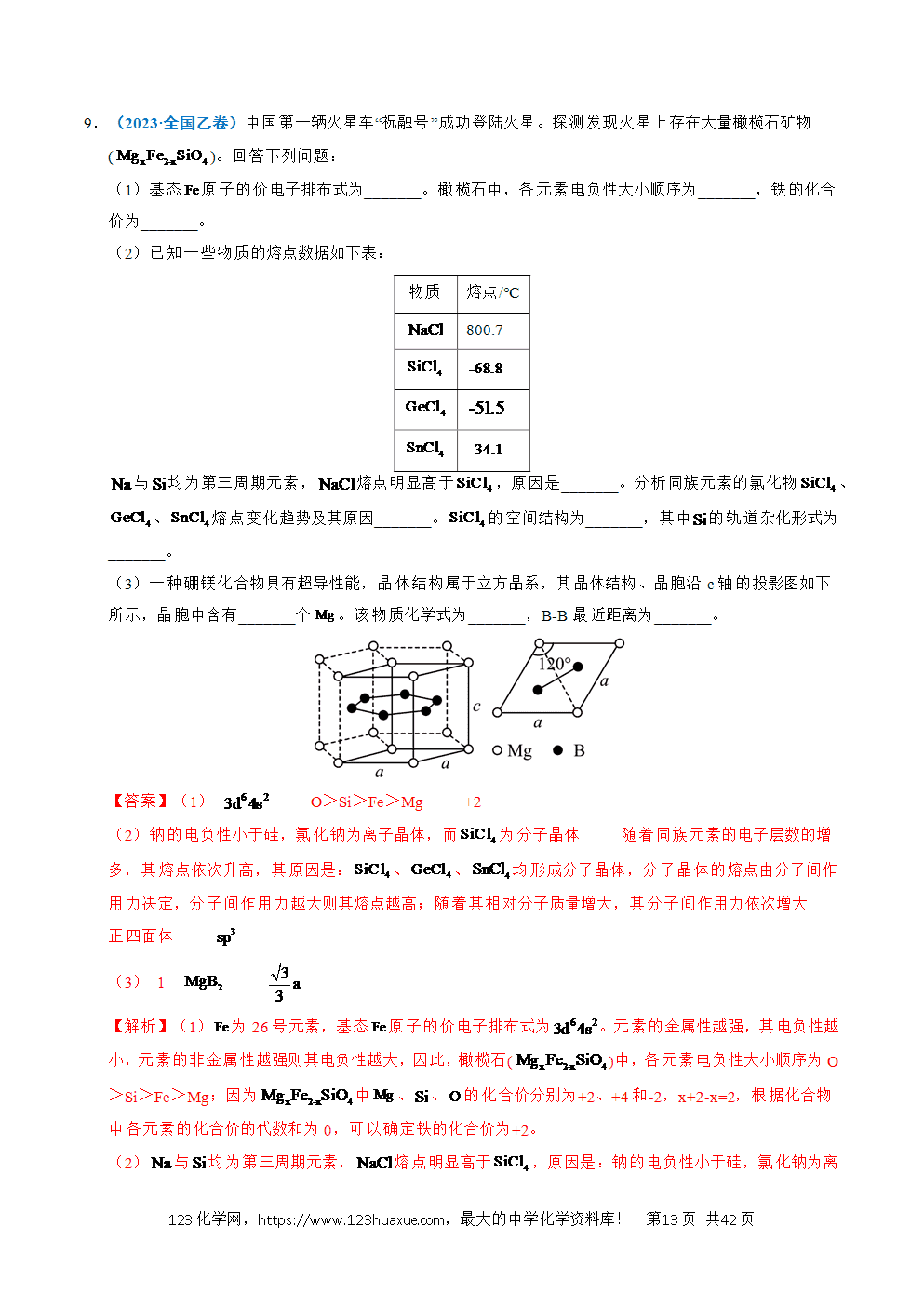
(3)可用作合成氨催化剂、其体心立方晶胞如图所示(晶胞边长为)。
①晶胞中原子的半径为 。
②研究发现,晶胞中阴影所示m,n两个截面的催化活性不同,截面单位面积含有原子个数越多,催化活性越低。m,n截面中,催化活性较低的是 ,该截面单位面积含有的原子为 个。
【答案】(1)四 VIII 4:5
(2)N O sp2 O
(3) n