















考向一 无机物(气体)的制备实验综合题
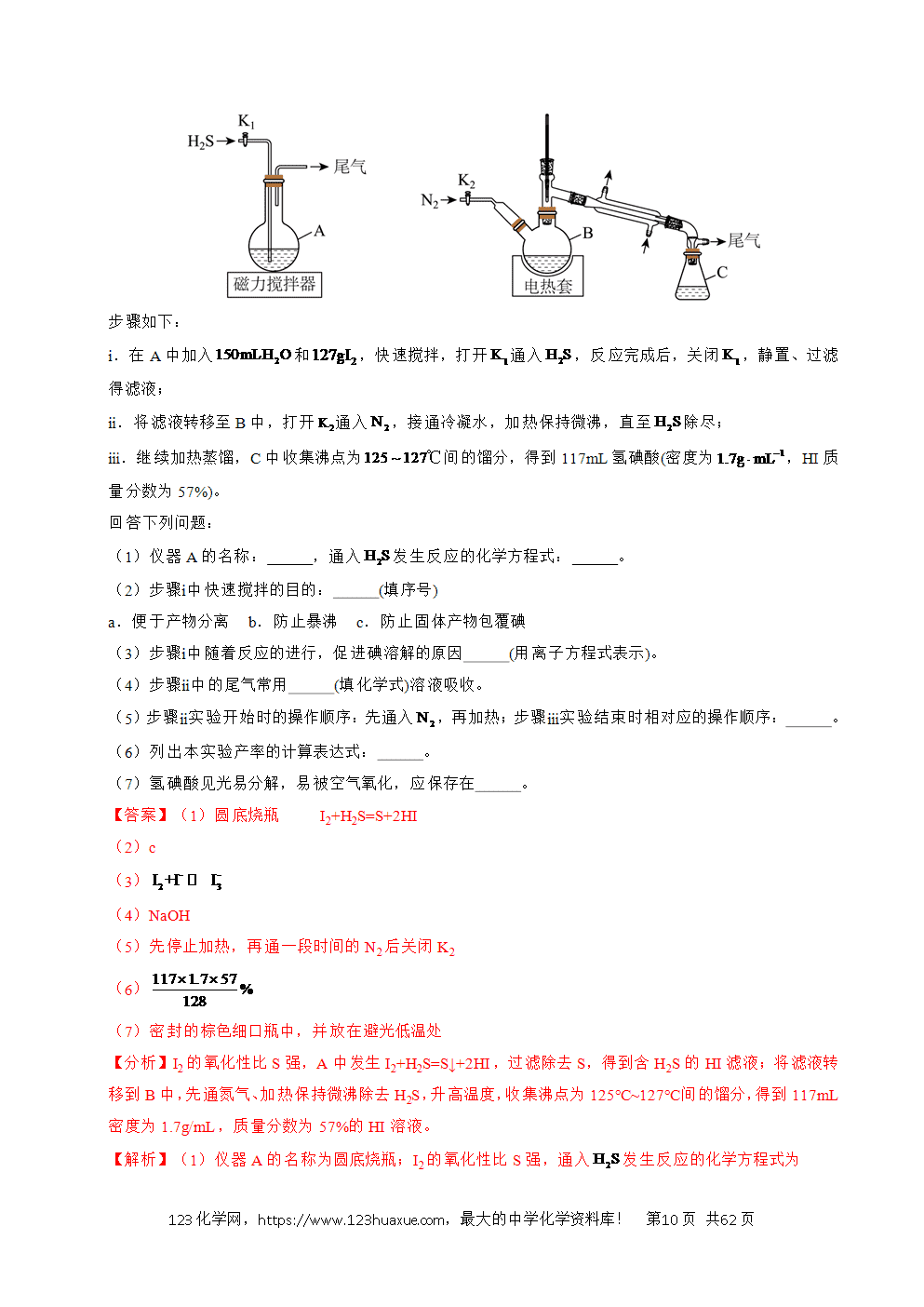
1.(2025·陕晋青宁卷)某实验室制备糖精钴,并测定其结晶水含量。
已知:表示糖精根离子,其摩尔质量为,糖精钴的溶解度在热水中较大,在冷水中较小;丙酮沸点为,与水互溶。
(一)制备
I.称取,加入蒸馏水,搅拌溶解,得溶液1。
Ⅱ.称取(稍过量)糖精钠(),加入蒸馏水,加热搅拌,得溶液2。
Ⅲ.将溶液2加入到接近沸腾的溶液1中,反应3分钟后停止加热,静置,冷却结晶。
Ⅳ.过滤,依次用三种不同试剂洗涤晶体,晾干得产品。
回答下列问题:
(1)I和Ⅱ中除烧杯外,还需用到的玻璃仪器有 、 (写出两种)
(2)Ⅲ中静置过程有少量晶体出现时,可将烧杯置于 中,以使大量晶体析出。
(3)Ⅳ中用①丙酮、②冷水、③冷的溶液洗涤晶体,正确顺序为 。
A.①③② B.③②① C.②①③
(4)Ⅳ中为了确认氯离子己经洗净,取水洗时的最后一次滤液于试管中, (将实验操作、现象和结论补充完整)。
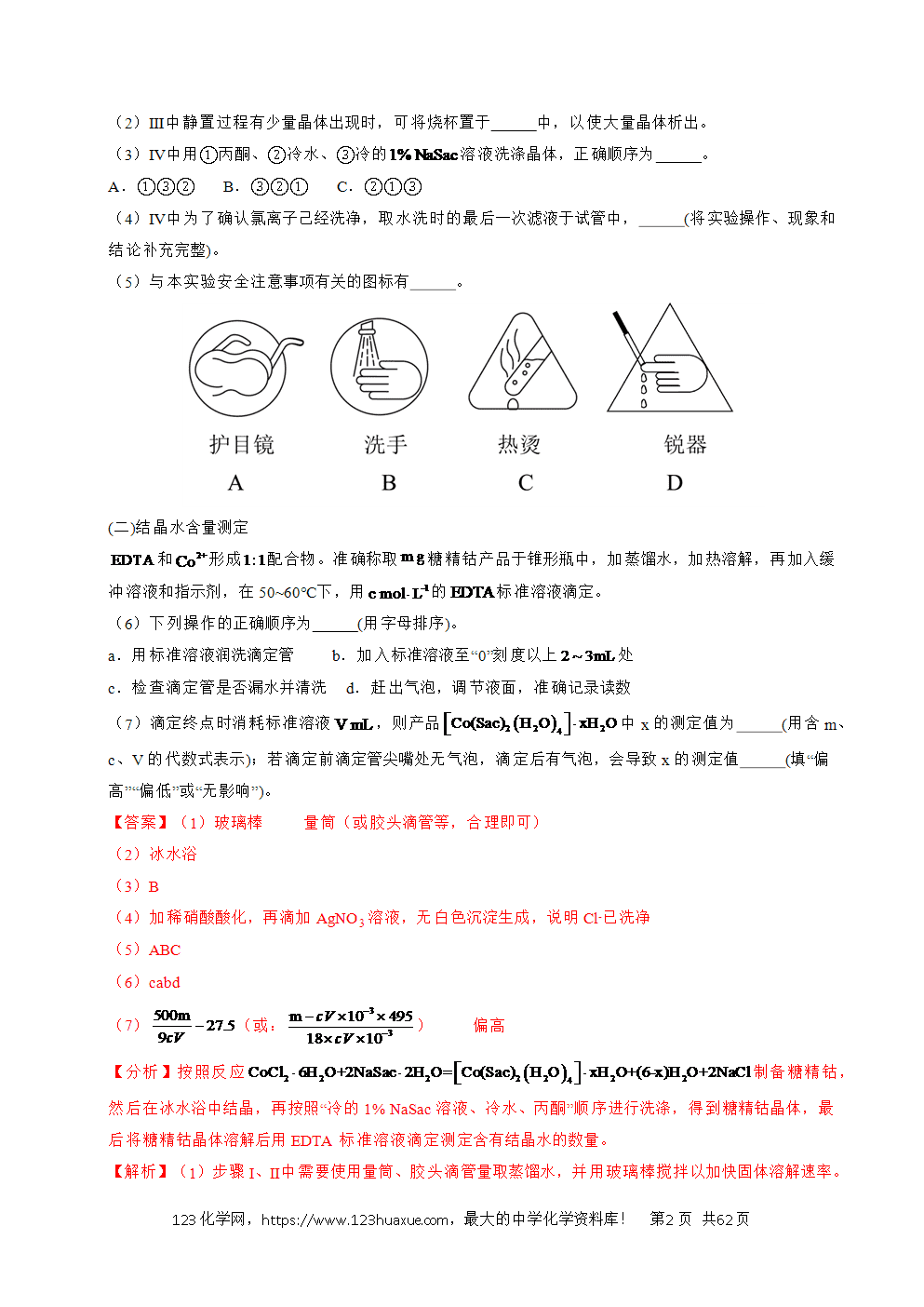
(5)与本实验安全注意事项有关的图标有 。
(二)结晶水含量测定
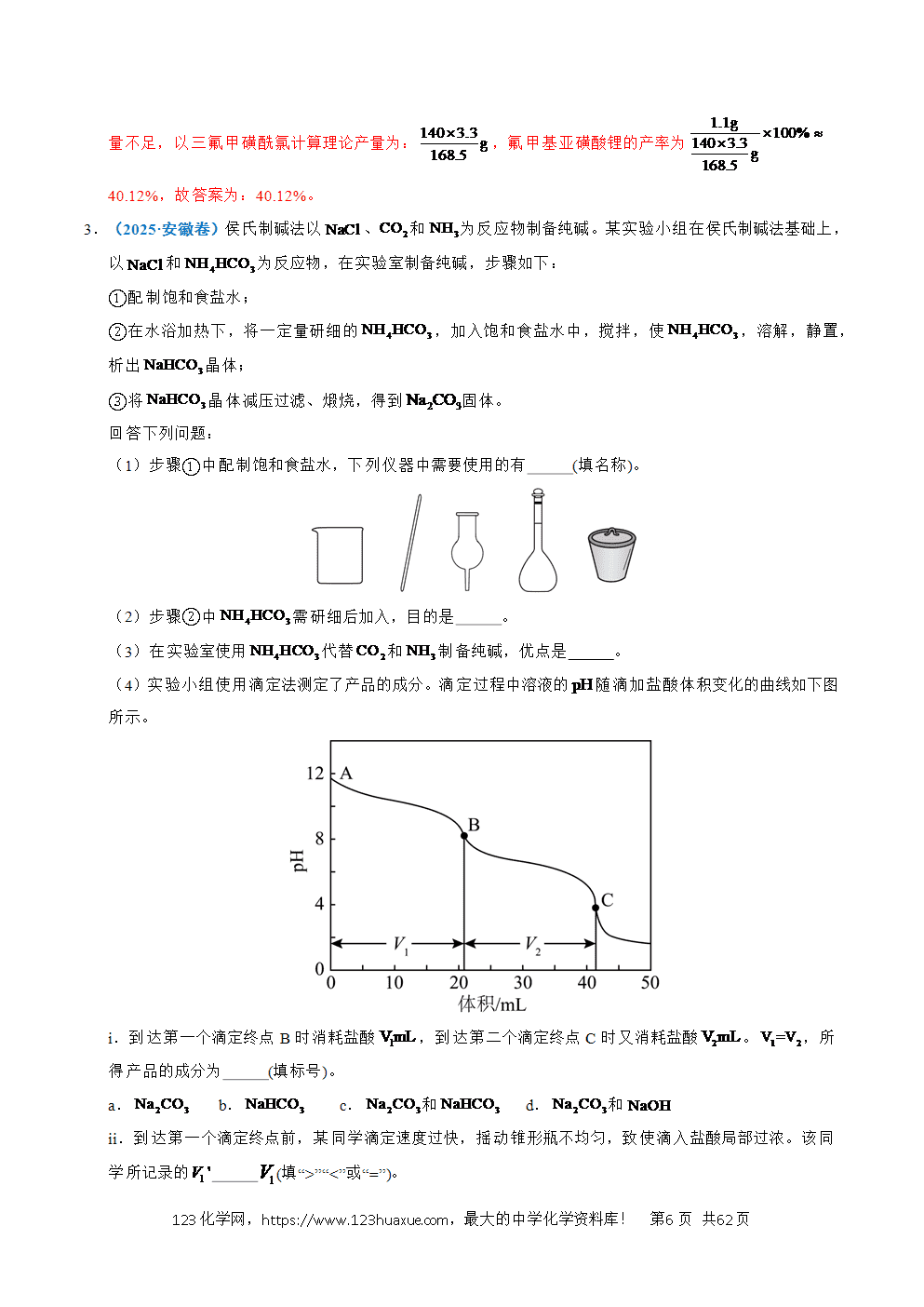
和形成配合物。准确称取糖精钴产品于锥形瓶中,加蒸馏水,加热溶解,再加入缓冲溶液和指示剂,在50~60℃下,用的标准溶液滴定。
(6)下列操作的正确顺序为 (用字母排序)。
a.用标准溶液润洗滴定管 b.加入标准溶液至“0”刻度以上处
c.检查滴定管是否漏水并清洗 d.赶出气泡,调节液面,准确记录读数
(7)滴定终点时消耗标准溶液,则产品中x的测定值为 (用含m、c、V的代数式表示);若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会导致x的测定值 (填“偏高”“偏低”或“无影响”)。
【答案】(1)玻璃棒 量筒(或胶头滴管等,合理即可)
(2)冰水浴
(3)B
(4)加稀硝酸酸化,再滴加AgNO3溶液,无白色沉淀生成,说明Cl-已洗净
(5)ABC
(6)cabd
(7)(或:) 偏高
【分析】按照反应制备糖精钴,然后在冰水浴中结晶,再按照“冷的1% NaSac溶液、冷水、丙酮”顺序进行洗涤,得到糖精钴晶体,最后将糖精钴晶体溶解后用EDTA标准溶液滴定测定含有结晶水的数量。
【解析】(1)步骤I、Ⅱ中需要使用量筒、胶头滴管量取蒸馏水,并用玻璃棒搅拌以加快固体溶解速率。
(2)因为糖精钴在冷水中溶解度较小,所以为了尽快让大量晶体析出,应降低溶液温度,可将烧杯置于冰水浴中。
(3)先用冷的1% NaSac溶液洗涤,可降低糖精钴溶解度,减少晶体损失,还能将晶体表面吸附的Co2+转化为晶体析出,且不引入新的杂质,再用冷水洗涤,可降低晶体溶解度并洗去溶液中存在的可溶性离子,丙酮可以与水互溶且沸点比关键水的低,故最后用丙酮洗涤以除去残留的水且能使晶体快速干燥,故答案为B。
(4)Ⅳ中为了确认氯离子己经洗净的步骤为:取水洗时的最后一次滤液于试管中,加稀硝酸酸化,再滴加AgNO3溶液,无白色沉淀生成,说明Cl-已洗净。
(5)进行化学实验需要佩戴护目镜,以保护眼睛,同时化学实验结束后,离开实验室前需用肥皂等清洗双手,该实验涉及加热操作,因此需要防止热烫,要选择合适的工具进行操作,避免直接触碰,故A、B、C符合题意;该实验中未涉及锐器的操作,D不符合题意,故答案为ABC。
(6)使用滴定管前首先要检漏,确定不漏液之后用蒸馏水清洗(c),再用待装的标准溶液进行润洗(a),待润洗完成后 装入标准溶液至“0”刻度以上2~3 mL处(b),放液赶出气泡后调节液面至“0”刻度或“0”刻度下,准确记录标准溶液体积的初始读数(d),故答案为cabd。
(7)滴定消耗的,EDTA与Co2+形成1:1配合物,则样品溶解后的,即样品中的,而,所以,解得;若滴定前滴定管尖嘴处无气泡,滴定后有气泡,测得消耗EDTA溶液体积偏小,即V偏小,根据,则x偏高。
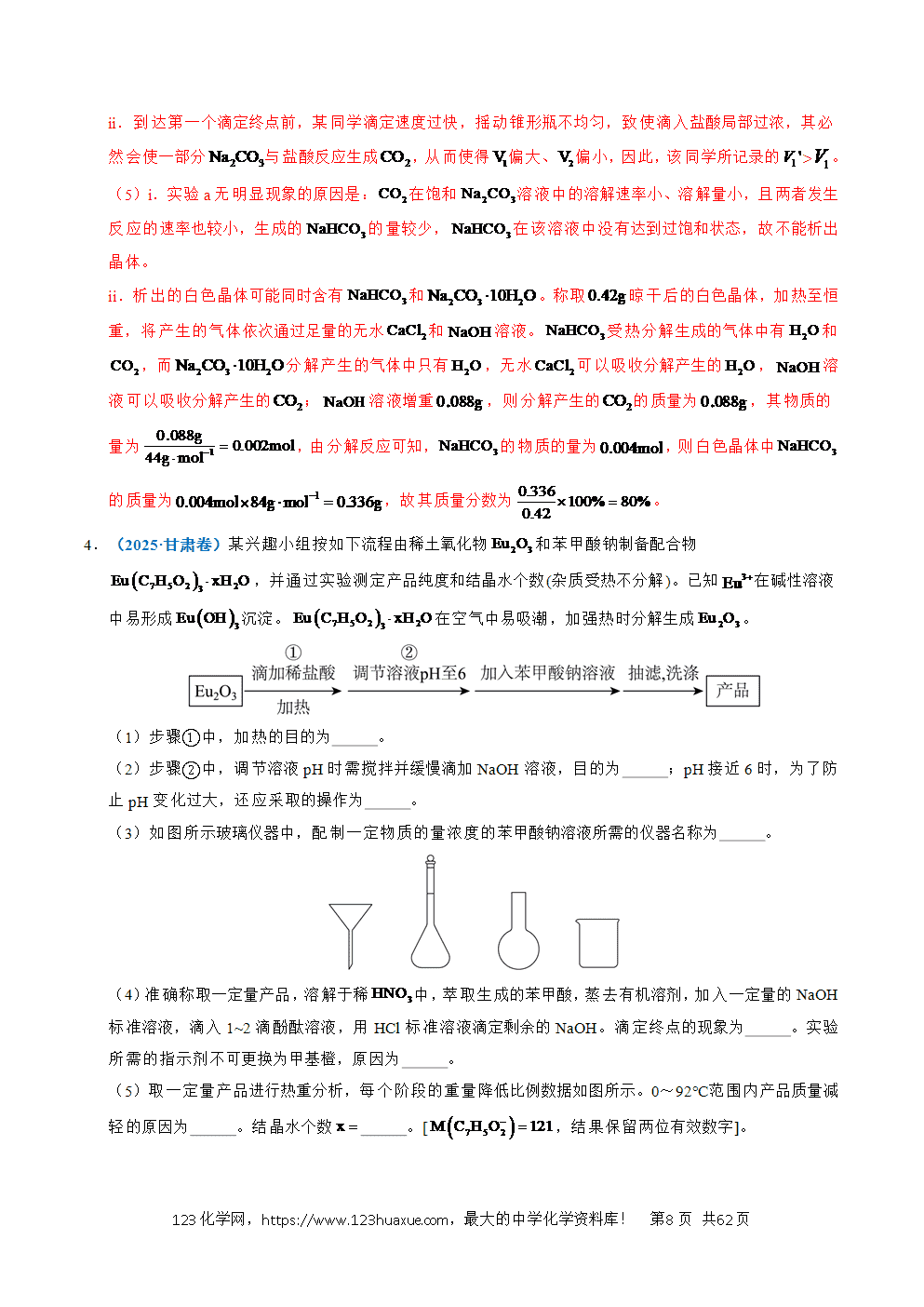
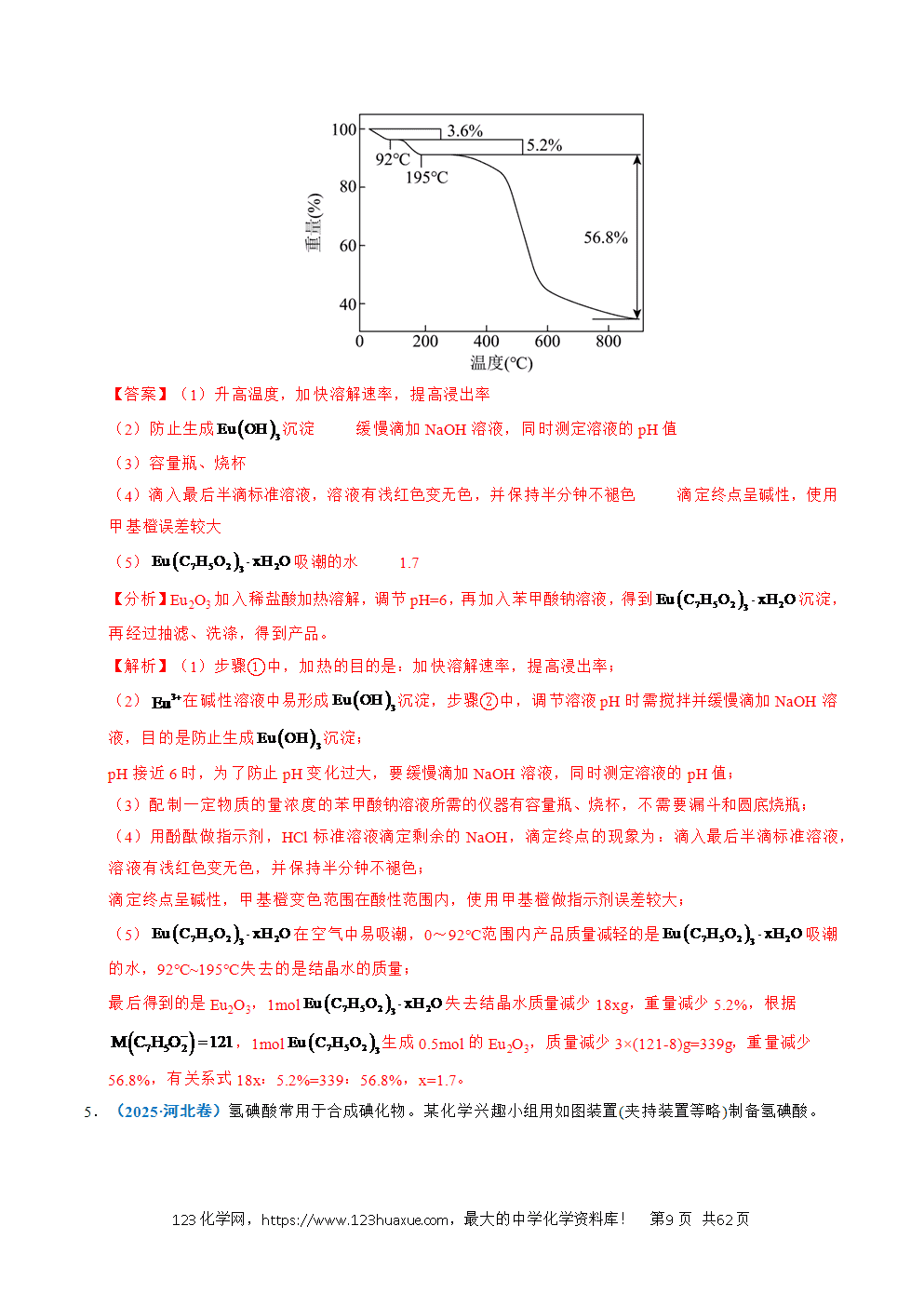
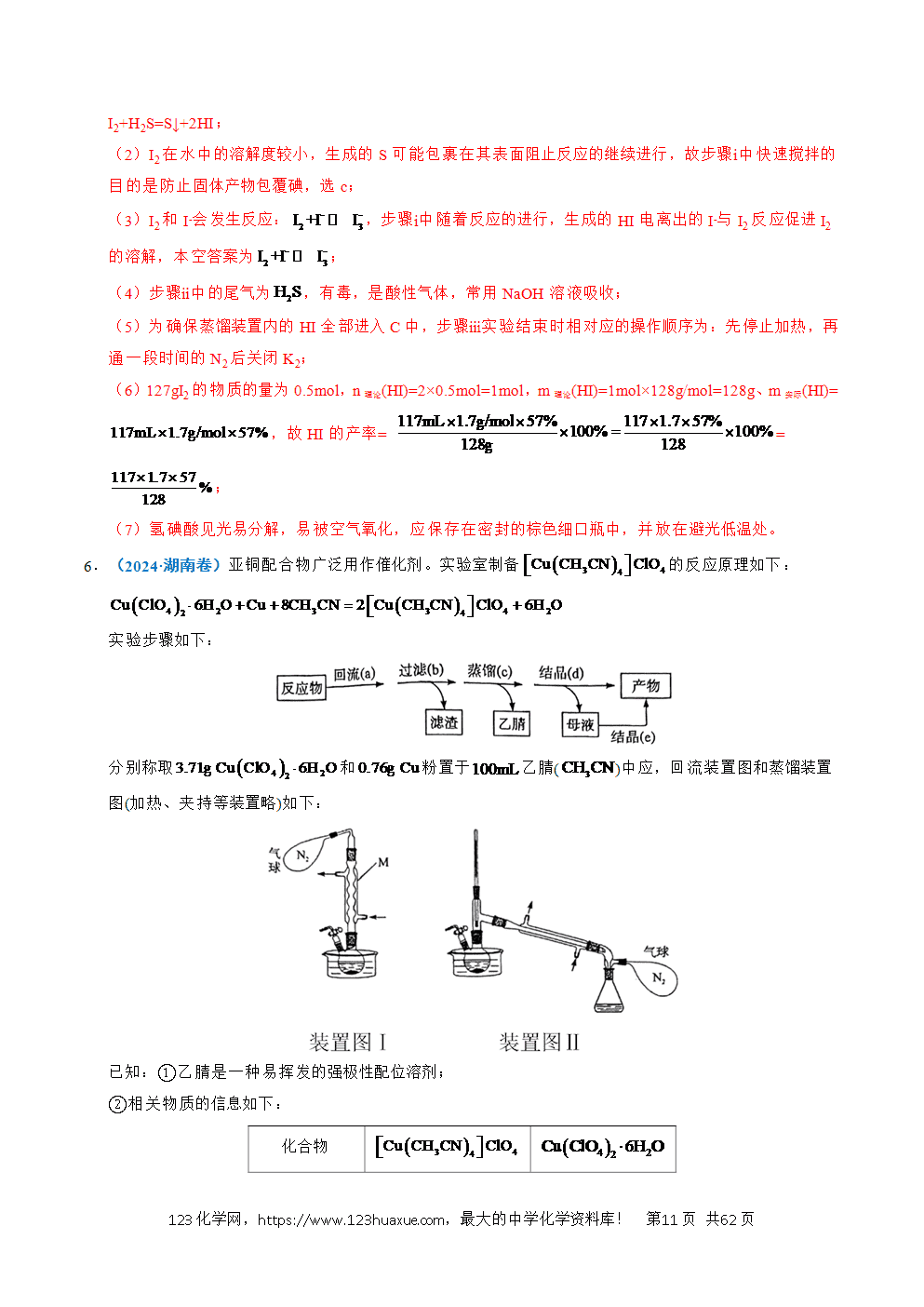
2.(2025·云南卷)三氟甲基亚磺酸锂是我国科学家通过人工智能设计开发的一种锂离子电池补锂剂,其合成原理如下:
实验步骤如下:
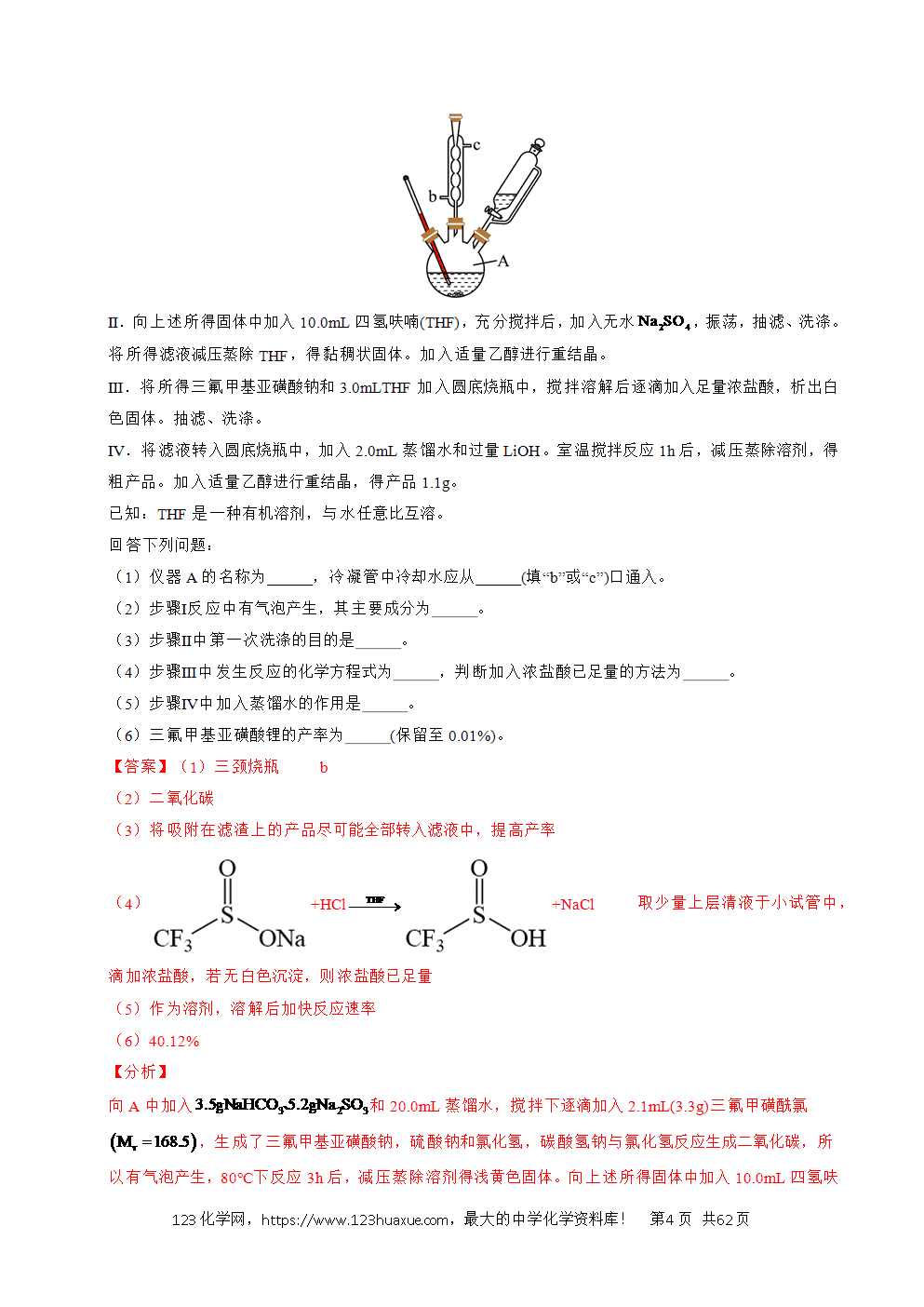
Ⅰ.向A中加入和20.0mL蒸馏水,搅拌下逐滴加入2.1mL(3.3g)三氟甲磺酰氯,有气泡产生(装置如图,夹持及加热装置省略)。80℃下反应3h后,减压蒸除溶剂得浅黄色固体。
Ⅱ.向上述所得固体中加入10.0mL四氢呋喃(THF),充分搅拌后,加入无水,振荡,抽滤、洗涤。将所得滤液减压蒸除THF,得黏稠状固体。加入适量乙醇进行重结晶。
Ⅲ.将所得三氟甲基亚磺酸钠和3.0mLTHF加入圆底烧瓶中,搅拌溶解后逐滴加入足量浓盐酸,析出白色固体。抽滤、洗涤。
Ⅳ.将滤液转入圆底烧瓶中,加入2.0mL蒸馏水和过量LiOH。室温搅拌反应1h后,减压蒸除溶剂,得粗产品。加入适量乙醇进行重结晶,得产品1.1g。
已知:THF是一种有机溶剂,与水任意比互溶。
回答下列问题:
(1)仪器A的名称为 ,冷凝管中冷却水应从 (填“b”或“c”)口通入。
(2)步骤Ⅰ反应中有气泡产生,其主要成分为 。
(3)步骤Ⅱ中第一次洗涤的目的是 。
(4)步骤Ⅲ中发生反应的化学方程式为 ,判断加入浓盐酸已足量的方法为 。
(5)步骤Ⅳ中加入蒸馏水的作用是 。
(6)三氟甲基亚磺酸锂的产率为 (保留至0.01%)。
【答案】(1)三颈烧瓶 b
(2)二氧化碳
(3)将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率
(4)+HCl+NaCl 取少量上层清液于小试管中,滴加浓盐酸,若无白色沉淀,则浓盐酸已足量
(5)作为溶剂,溶解后加快反应速率
(6)40.12%
【分析】
向A中加入和20.0mL蒸馏水,搅拌下逐滴加入2.1mL(3.3g)三氟甲磺酰氯,生成了三氟甲基亚磺酸钠,硫酸钠和氯化氢,碳酸氢钠与氯化氢反应生成二氧化碳,所以有气泡产生,80℃下反应3h后,减压蒸除溶剂得浅黄色固体。向上述所得固体中加入10.0mL四氢呋喃(THF),充分搅拌后,加入无水,可促进硫酸钠结晶析出,振荡,抽滤,除去硫酸钠,洗涤可将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率。将所得滤液减压蒸除THF,得黏稠状固体。加入适量乙醇进行重结晶。将所得三氟甲基亚磺酸钠和3.0mLTHF加入圆底烧瓶中,搅拌溶解后逐滴加入足量浓盐酸,发生的化学方程式为:+HCl+NaCl,析出白色固体。抽滤、洗涤。将滤液转入圆底烧瓶中,加入2.0mL蒸馏水和过量LiOH,水可作为溶剂,溶解后加快反应速率,室温搅拌反应1h后,减压蒸除溶剂,得粗产品。加入适量乙醇进行重结晶,得产品1.1g,据此解答。
【解析】(1)由图可知,A为三颈烧瓶,中间为冷凝管,为了提高冷凝效果,冷却水从b口通入,c口流出,故答案为:三颈烧瓶;b;
(2)向A中加入和20.0mL蒸馏水,搅拌下逐滴加入2.1mL(3.3g)三氟甲磺酰氯,生成了三氟甲基亚磺酸钠,硫酸钠和氯化氢,碳酸氢钠与氯化氢反应生成二氧化碳,所以有气泡产生,故答案为:二氧化碳;
(3)A中反应生成了三氟甲基亚磺酸钠,硫酸钠和氯化氢等,上述所得固体中加入10.0mL四氢呋喃(THF),充分搅拌后,加入无水,可促进硫酸钠结晶析出,振荡,抽滤除去硫酸钠等固体、洗涤,洗涤可将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率,故答案为:将吸附在滤渣上的产品尽可能全部转入滤液中,提高产率;
(4)
由分析可知,将所得三氟甲基亚磺酸钠和3.0mLTHF加入圆底烧瓶中,搅拌溶解后逐滴加入足量浓盐酸,发生的化学方程式为:+HCl+NaCl,析出白色固体,所以判断加入盐酸已足量的方法为:取少量上层清液于小试管中,滴加浓盐酸,若无白色沉淀,则浓盐酸已足量,故答案为:+HCl+NaCl;取少量上层清液于小试管中,滴加浓盐酸,若无白色沉淀,则浓盐酸已足量;
(5)将滤液转入圆底烧瓶中,加入2.0mL蒸馏水和过量LiOH,水可作为溶剂,溶解后加快反应速率,故答案为:作为溶剂,溶解后加快反应速率;
(6)已知向A中加入,2.1mL(3.3g)三氟甲磺酰氯,三氟甲磺酰氯量不足,以三氟甲磺酰氯计算理论产量为:,氟甲基亚磺酸锂的产率为40.12%,故答案为:40.12%。