











一、元素周期表(18分)
元素周期律和周期表是人们研究和学习化学的重要工具。
1.元素周期表中钛的数据如图所示, 其中47.87的含义是___________。
A.元素的相对原子质量 B.原子的相对原子质量
C.元素的近似相对原子质量 D.原子的近似相对原子质量
2.锡(Sn)是很早便被发现和使用的金属,其原子结构示意图如图所示:
已知锡(Sn)为主族元素,在元素周期表中的位置是___________。
3.下列关于元素周期表说法正确的是___________。
A.最外层电子数为2的原子都属于IIA族 B.有3个短周期
C.零族元素最外层均为8电子稳定结构 D.IA族全部是金属元素
4.下列关于元素周期表的叙述正确的是___________(双选)。
A.元素周期表共有7个横行,称为周期;共有16个纵行,称为族
B.前18号元素称为短周期元素
C.在周期表中金属与非金属的分界处可以找到半导体材料
D.在周期表的右下角寻找农药
5.硒元素最高价氧化物水化物对应的化学式为______,写出SeO2和H2Se反应的化学方程式:_________。
6.2016年 IUPAC将第117号元素命名为Ts(中文名,音tian),TS是第七周期第ⅦA族元素。下列说法中,不正确的是___________。
A.Ts的最外层电子数是7 B.Ts原子原子半径比At原子大
C.Ts在同族元素中非金属性最弱 D.中子数为176的Ts,其核素符号是
7.下列说法中,能说明氯的非金属性比硫强的事实是___________。
A.酸性:HClO>HClO4 B.氧化性:HClO>H2SO3
C.热稳定性:HCl>H2S D.酸性:HCl>H2S
8.W、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,其中W的质子数是X的2倍。下列说法错误的是___________。
A.X的原子半径比Y的大
B.Z的最高价氧化物的水化物的酸性比W的强
C.Z元素的气态氧化物的热稳定性比Y的高
D.X元素的单质能从H₂W溶液中置换出W元素的单质
【答案】1.A(2分)
2.第五周期第IVA族(2分)
3.B(2分)
4.BC(2分)
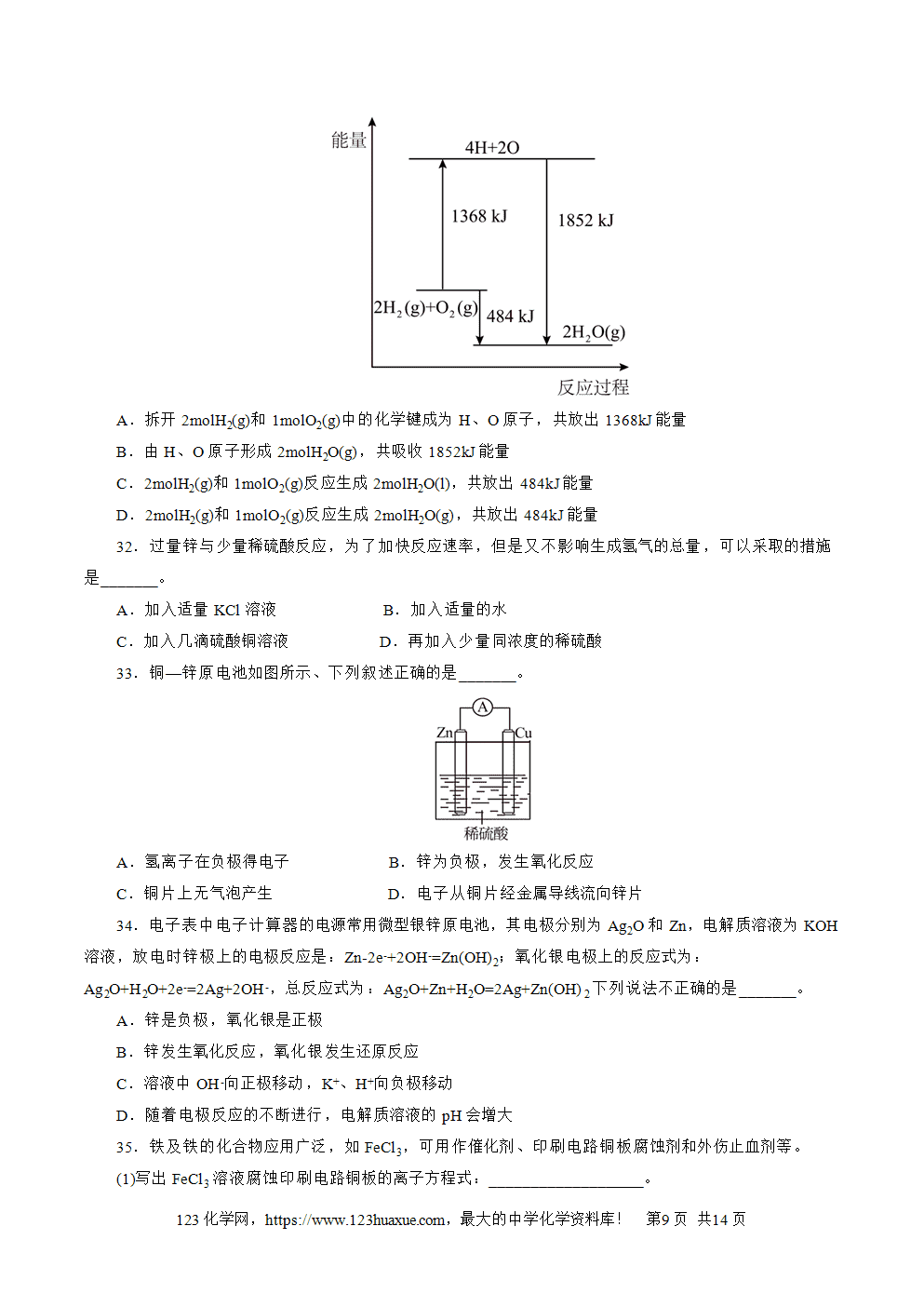
5.①H2SeO4(2分) ②SeO2+2H2Se=3Se↓+2H2O(2分)
6.D(2分)
7.C(2分)
8.C(2分)
【解析】1.元素周期表元素符号下方的数字代表该元素的相对原子质量,则47.87的含义是钛元素的相对原子质量为47.87,故选A。
2.锡(Sn)原子核外有5个电子层,最外层有4个电子,所以处于周期表中第五周期第IVA族。
3.A项,最外层电子数为2的原子不一定都属于IIA族,如氦(He)原子最外层电子数为2,但它属于零族元素;一些过渡金属元素原子的最外层电子数也可能为2,A错误;B项,元素周期表中第一、二、三周期为短周期,各周期包含元素种类数较少,所以有3个短周期,B正确;C项,零族元素中,氦(He)最外层电子数为2,不是8电子稳定结构,其余零族元素最外层为8电子稳定结构,C错误;D项,IA族中氢(H)元素是非金属元素,并非全部是金属元素,D错误;故选B。
4.A项,元素周期表中横行称为周期,元素周期表共有7个横行;共有18个纵行,16个族,故A错误;B项,第一周期到第三周期为短周期,包含前18号元素,称为短周期元素,故B正确;C项,在元素周期表中金属与非金属的分界处附近元素半导体性能较好,可以找到半导体材料;故C正确;D项,在F、Cl、S、P附近寻找制备农药的元素,即在元素周期表的右上方附近寻找制备新型农药的元素,故D错误;故选BC。
5.Se与S同主族,则Se的最高化合价为+6,其最高价氧化物对应的水化物化学式为H2SeO4;SeO2和H2Se反应类似于SO2与H2S的反应,则反应的化学方程式为:SeO2+2H2Se=3Se↓+2H2O。
6.A项,主族元素最外层电子数等于所在的族序数,Ts原子序数为117,位于第七周期ⅦA族,Ts的最外层电子数是7,故A正确;B项,At位于第六周期ⅦA族,同主族从上到下,原子半径增大,即Ts的原子半径大于At的原子,故B正确;C项,同主族从上到下非金属性减弱,Ts在同族元素中非金属性最弱,故C正确;D项,质量数=质子数+中子数=117+176=293,因此该核素的符号是,故D错误;故选D。
7.A项,酸性应是:HClO4>HClO,不能说明Cl元素非金属性强于S,故A不选;B项,含氧酸的氧化性不能说明非金属性氯比硫强,故B不选;C项,气态氢化物热稳定性越好,非金属性越强,热稳定性:HCl>H2S,能说明非金属性氯比硫强,故C选;D项,氢化物的酸性不能说明非金属性氯比硫强,故D不选;故选C。
8.根据各元素在周期表中的位置,且W的质子数是X的2倍,可知W为S,故X为O,Y为F,Z为Cl。A项,同周期元素,从左到右,原子半径逐渐减小,故X的原子半径大于Y,A正确;B项,元素非金属性越强,最高价氧化物水化物酸性越强,非金属性Z>W,故Z的最高价氧化物的水化物的酸性比W的强,B正确;C项,气态氧化物热稳定性和元素非金属性没有必然联系,C错误;D项,O2与H2S反应可以生成H2O和S,即X元素的单质能从H2W溶液中置换出W元素的单质,D正确;故选C。
二、金属的独白(16分)
金属及其化合物的实验探究和类比探究对化学学习有重要意义,回答下列有关问题:
9.关于实验室探究钠及其化合物的性质,下列说法正确的有___________(双选)。
A.在火焰上灼烧搅拌过某无色溶液的玻璃棒,火焰出现黄色,说明溶液含钠元素
B.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数与1molNa2O2固体中含离子总数的比值为
D.在实验探究结束后,剩余的金属钠可以直接放回原试剂瓶中
10.下列有关金属及其化合物的化学方程式或离子方程式书写正确的是___________。
A.明矾溶液与过量氨水混合:Al3++3NH3·H2O=Al(OH)3↓ +3NH4+
B.铁与碘反应生成碘化铁:2Fe+6I22FeI3
C.硫化亚铁与浓硫酸混合加热:2H++FeS=H2S+Fe2+
D.向H2O2溶液中滴加少量FeCl3溶液产生气泡的原因:2Fe3++H2O2=O2↑+2H++2Fe2+
11.类比法可以用于方程式书写,钾不能置换出NaCl溶液中的钠,理由是:___________。(用化学方程式说明)
12.探究金属及其化合物的目的是结合它们的性质并加以利用,下列说法中错误的是___________(双选)。
A.高压钠灯可用于道路照明
B.小苏打用作食品膨松剂涉及氧化还原反应
C.氢氧化铝和小苏打可用于中和过多的胃酸
D.FeCl3可以用作净水剂
E.铁粉和氧化铝发生的铝热反应可用于焊接铁轨
F.氧化铝和氧化镁熔点高,常用于制造耐高温材料
13.既然金属及其化合物有着广泛应用,那么冶炼和获取金属就十分必要,下列说法中正确的是___________。
A.黄铜矿的主要成分为:Cu2S
B.铝土矿的主要成分为:Al2O3
C.工业上可以通过电解六水合氯化镁制取金属镁
D.可用H2还原MgO制备单质Mg
14.实际生活运用金属及其化合物时,要关注其腐蚀问题。下列说法中正确的是___________(双选)。
A.铁锈的主要成分可表示为:Fe2O3·nH2O
B.室温下,Fe与浓H2SO4反应生成FeSO4
C.Fe在稀硝酸中发生钝化
D.将生铁进一步炼制减少含碳量,能得到耐腐蚀的钢
15.实验目的:检验溶液中FeSO4是否被氧化。请根据该实验目的设计你的实验:___________。
16.镁在空气和氧气中点燃产物___________(选填“相同”或“不同”),铁在氯气中燃烧实验现象为___________。
【答案】9.CD(2分)
10.A(2分)
11.2K+2H2O=2KOH+H2↑(2分)
12.BE(2分)
13.B(2分)
14.AD(2分)
15.取少量待测液,滴加KSCN溶液,若变红则FeSO4已被氧化,反之则无(2分)
16.①不同(1分) ②生成棕褐色烟(1分)