








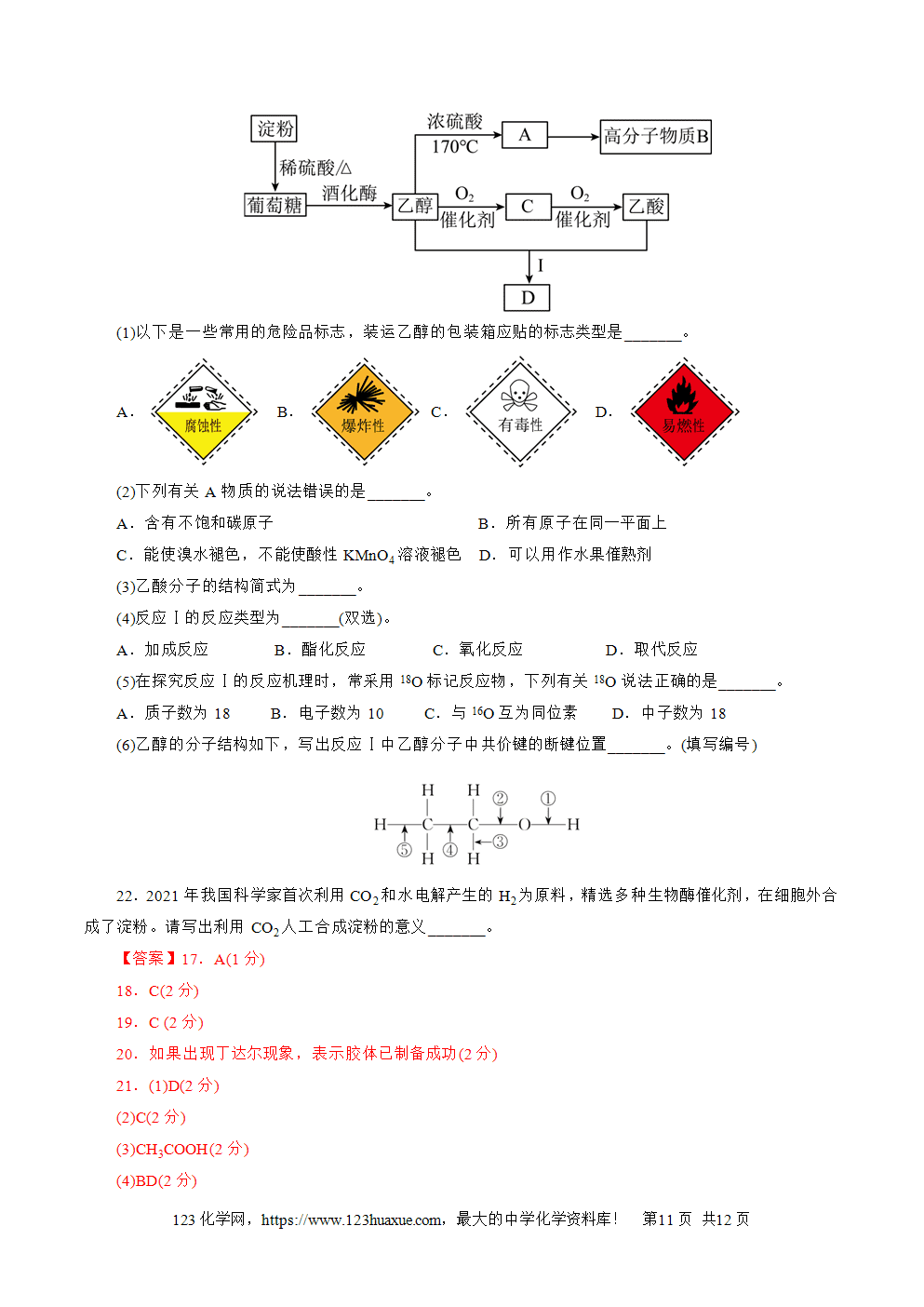
一、中国学者代言的化学元素(22分)
为纪念元素周期表诞生150周年,IUPAC等向世界介绍了118位优秀青年化学家,并形成一张“青年化学家元素周期表”。
1.中国学者雷晓光、姜雪峰、刘庄分别成为“7N、16S、80Hg”元素的代言人。
(1)上述元素中,属于短周期元素且原子最外层电子数最多的是___________(填元素符号)。
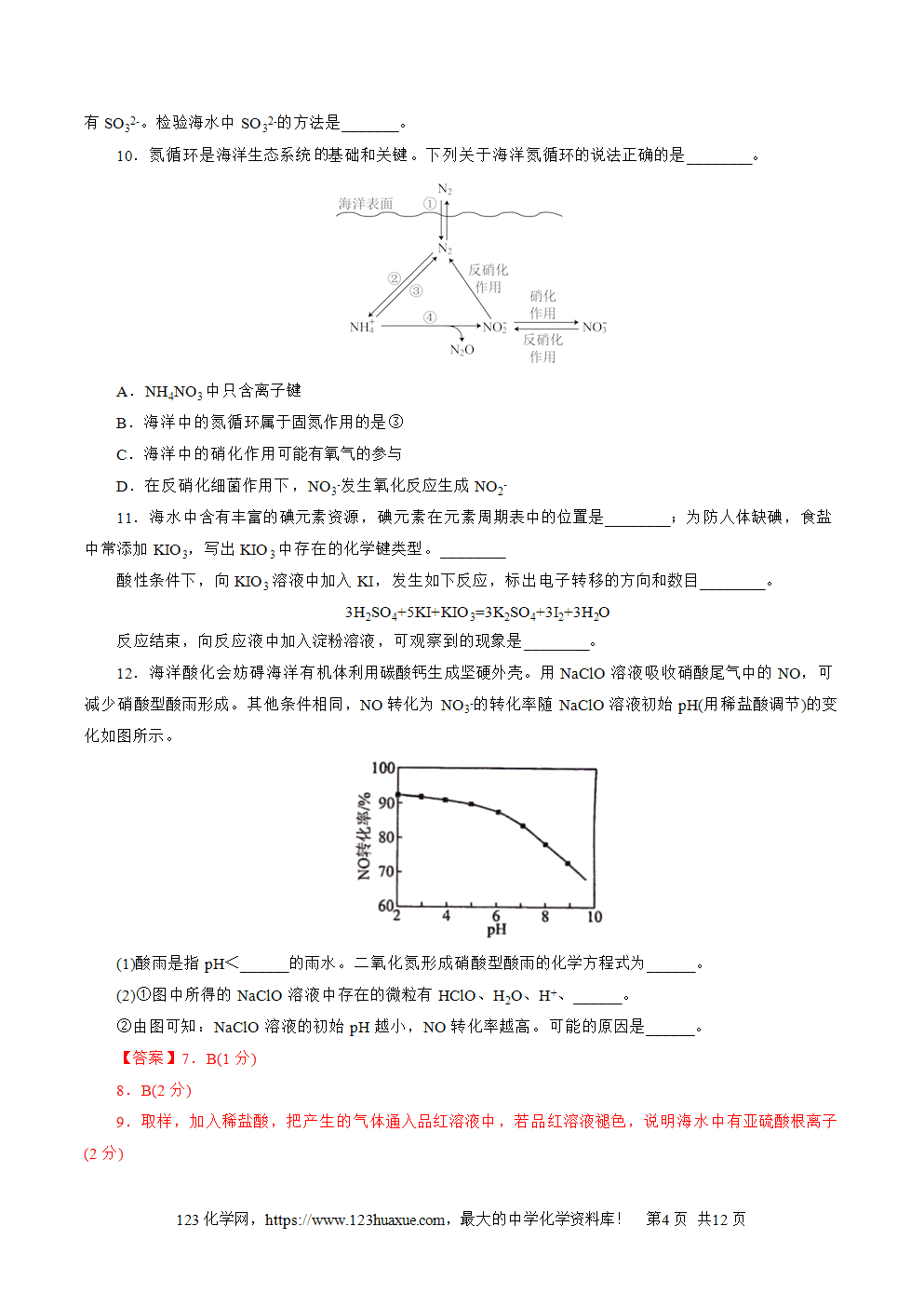
(2)图1为元素周期表中汞元素的信息示意图;图2为缺少信息的汞的原子结构示意图。
由此判断,汞元素位于元素周期表的第___________周期,图1中200.59表示___________,图2中的x=___________。
2.我国晋代炼丹家、医学家葛洪所著《抱扑子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”,即加热红色硫化汞(丹砂)分解出汞,而汞和硫黄又能重新变为红色硫化汞。下列说法错误的是___________。
A.上述反应涉及两种基本反应类型
B.应隔绝空气实现上述物质的转化
C.丹砂与水银均可与稀硫酸反应生成氢气
D.汞蒸气有毒,中国古代“炼丹术”并不科学
3.硒(Se)与硫位于同一主族,均是生命必需元素。下列推断正确的是___________。
A.酸性: B.热稳定性:
C.二氧化硒(SeO2)只具有还原性 D.硒元素的最低负化合价为-2价
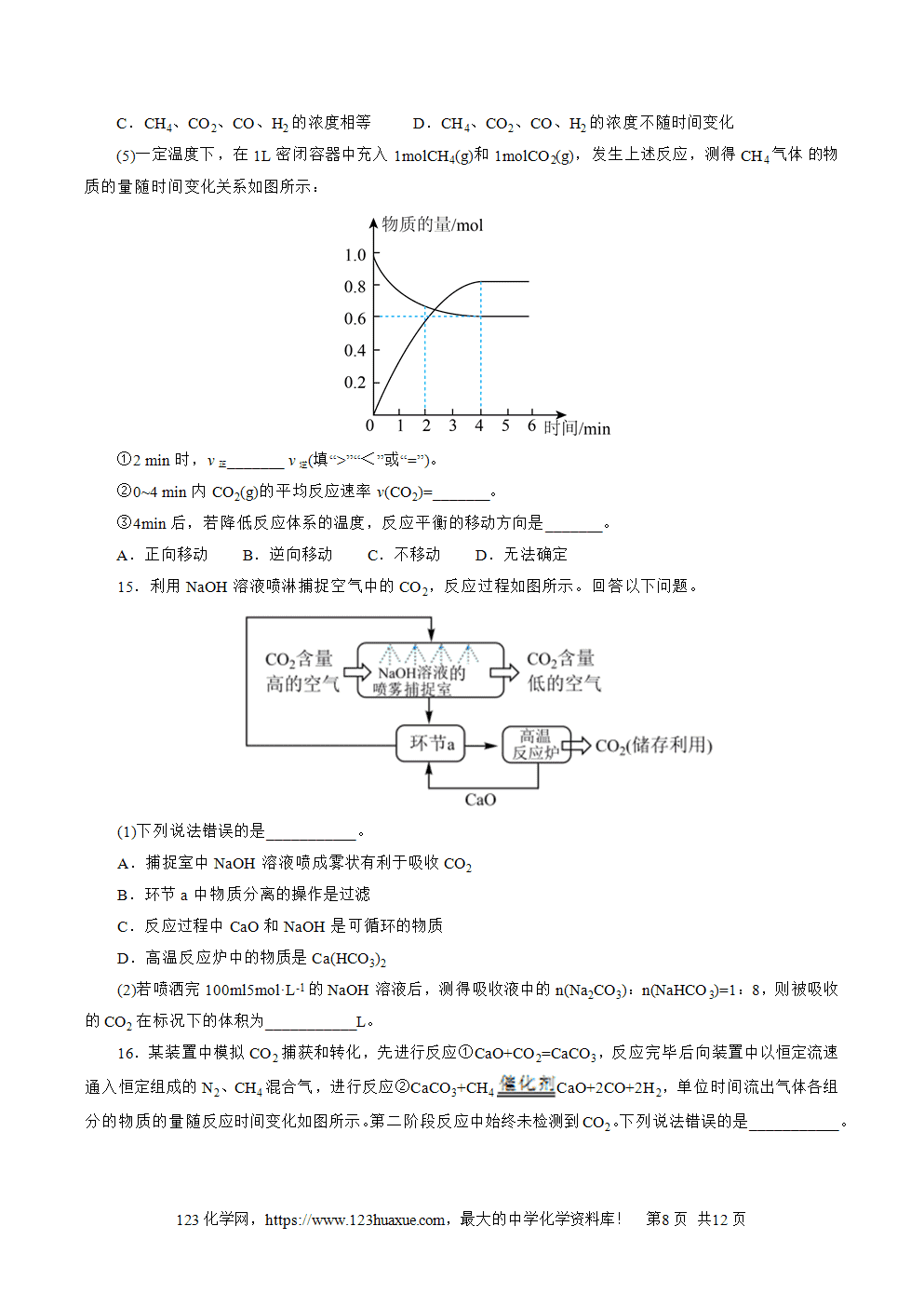
4.某品牌去屑洗发水的有效成分为二硫化硒(SeS2),利用元素周期律知识分析,SeS2中Se元素化合价呈正价的原因。___________。
5.中国科学家成功合成了世界上首个“五氮负离子”的盐——(N5)6(H3O)3(NH4)4Cl。该固体盐中存在的化学键类型有___________。1mol“五氮负离子”中所含的电子数为___________mol。
6.A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。请回答下列问题:
(1)B元素名称是___________,F元素在周期表中的位置___________。
(2)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐化学式分别为___________、___________,这两种酸式盐相互反应的离子方程式为___________。
(3)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子负离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为___________。
【答案】1.(1)S(1分)
(2)①六(1分) ②元素的相对原子质量(1分) ③2(1分)
2.C(2分)
3.D(2分)
4.同主族元素从上往下非金属性减弱,S元素的非金属性大于Se,得电子能力强(2分)
5.①共价键、离子键(2分) ②36(2分)
6.(1)①氮元素(1分) ②. 第三周期第ⅥA族(1分)
(2)①NaHSO3(1分) ②NaHSO4(1分) ③H++HSO3-=SO2↑+H2O(2分)
(3)HS−+OH−=S2−+H2O(2分)
【解析】(1)N、S、Hg三种元素中,属于短周期元素的为N、S,N最外层电子数为5,S最外层电子数为6,故属于短周期元素且原子最外层电子数最多的是S;
(2)由图1,汞元素原子序数是80,原子核外电子数为80,由图2可知,核外电子从最内层开始,每层上的电子数依次为2、8、18、32、18、x,可以解得x=2,核外电子层数为6,故汞元素位于元素周期表的第六周期,图1中200.59表示元素的相对原子质量。
2.丹砂烧之成水银,积变又还成丹砂”对应的化学方程式为:HgSHg+S、Hg+S=HgS。A项,上述反应涉及两种基本反应类型:分解反应与化合反应,A正确;B项,应隔绝空气实现上述物质的转化,因为在空气中灼烧会生成 HgO、二氧化硫,B正确;C项,丹砂与硫酸反应生成硫化氢,金属活动顺序Hg在H之后,不可以与硫酸反应生成H2,C错误;D项,汞蒸气有毒,中国古代“炼丹术”并不科学,D正确;故选C。
3.A项,非金属性越强,最高价氧化物对应水化物的酸性越强,同主族从上往下非金属性减弱,所以酸性H2SO4>H2SeO4,A错误;B项,非金属性越强,气态氢化物的稳定性越强,同主族从上往下非金属性减弱,H2Se<H2S,B错误;C项,二氧化硒(SeO2)中Se的化合价为+4价,处在Se的中间价态,既有氧化性又有还原性,C错误;D项,根据同主族元素的相似性可知,硒元素的最低负化合价为-2价,D正确;故选D。
4.同主族元素从上往下非金属性减弱,S元素的非金属性大于Se,得电子能力强,所以SeS₂中Se元素化合价呈正价。
5.①由题目可知,该物质为盐,由NH4+、H3O+、Cl-和N5-构成,阴离子和阳离子形成离子键,铵根离子内部有共价键;②N5-的电子数为5×7+1=36个,则1mol“五氮负离子”中所含的电子数为36mol。
6.A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子,则A为氢元素;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X,则B为氮元素,X为NH4NO3;D与A同主族,且D的原子序数大于N元素,故D为Na;F元素的最外层电子数是其次外层电子数的3/4倍,F原子只能有3个电子层,最外层电子数为6,故F为硫元素;A、B、D、 F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C为氧元素;D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,应氢氧化铝、强碱、强酸反应,可推知E为Al,则A、B、C、D、E、F分别为H、N、O、Na、Al、S。
(1)B元素名称是氮元素;F元素在周期表中的位置是第三周期第ⅥA族;
(2)A、C、D、F分别为H、O、N、S,四种元素可以形成两种酸式盐(均由四种元素组成)分别为NaHSO3、NaHSO4,二者相互反应的离子方程式为:H++ HSO3-=SO2↑+H2O;
(3)A、C、F分别为H、O、S,三者间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS−,乙为OH−,则甲与乙反应的离子方程式为:HS−+OH−=S2−+H2O。
二、液体工业原料—海洋(21分)
海洋是丰富的资源宝库,其中蕴藏着丰富的铁、钴、镍等金属资源以及硫、氮、卤素等非金属资源,被誉为“液体工业原料”。
7.在新生代的海水里有一种铁细菌,能利用酶为催化剂提取海水中的亚铁离子转变成自身皮鞘(可以用Fe2O3来表示其中的铁)。该反应过程体现了亚铁离子的_______。
A.氧化性 B.还原性
8.Fe2O3可制取新型、高效水处理剂高铁酸钾K2FeO4,K2FeO4在处理饮用水的过程中产生Fe(OH)3胶体。以下说法不正确的是________。
A.可以通过丁达尔现象区分胶体和溶液
B.氯化铁溶液与氢氧化铁胶体都能透过半透膜
C.胶体在一定条件下能够稳定存在
D.K2FeO4处理水时起到了氧化杀菌作用
9.SO42-是海洋中硫元素的主要存在形式之一,由于沿海地区燃煤电厂酸性气体的排放,海水中也会含有SO32-。检验海水中SO32-的方法是_______。