
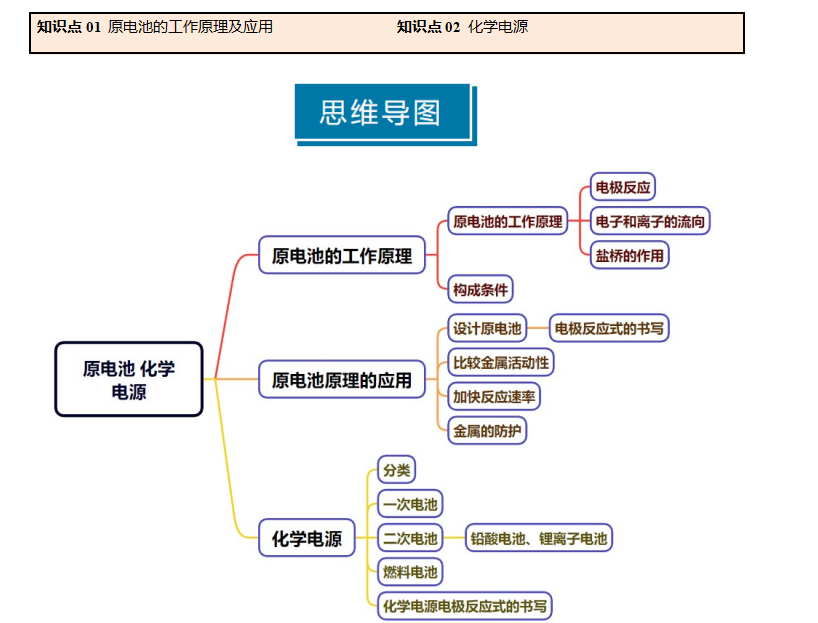
1.原电池的概念和实质
(1)概念:将化学能转化为电能的装置。
(2)实质:利用能自发进行的氧化还原反应把化学能转化为电能。
2.原电池的工作原理
(1)电极反应:
负极:失去电子,发生氧化反应
正极:得到电子,发生还原反应
(2)电子移动方向:从负极流出沿导线流入正极,电子不能通过电解质溶液。
(3)离子移动方向:
①阴离子向负极移动,阳离子向正极移动。
②如果有盐桥:盐桥中的阴离子移向负极区,阳离子移向正极区。
(4)盐桥的作用:
①离子通道,形成闭合回路。
②避免电极与电解质溶液直接反应,减少电流的衰减。
3.原电池的构成条件
①形成闭合回路;
②两个活性不同的电极,相对较活泼的金属作负极;
③电解质溶液或熔融电解质;
④自发的氧化还原反应(一般能对外界释放能量)。
【易错提醒】
(1)构成原电池的两电极材料不一定都是金属,正极材料可以为导电的非金属,例如石墨。两极材料可能参与反应,也可能不参与反应。
(2)两个活泼性不同的金属电极用导线连接,共同插入电解质溶液中不一定构成原电池,必须有一个能自发进行的氧化还原反应。
(3)在判断原电池正负极时,既要考虑金属活泼性的强弱,也要考虑电解质溶液性质。如Mg-Al-HCl溶液构成的原电池中,负极为Mg;但是Mg-Al-NaOH溶液构成的原电池中,负极为Al,正极为Mg。
4.原电池原理的应用
(1)设计制作化学电源
①用双线桥分析氧化还原反应的电子转移方向和数目;
②分别写出正、负极的电极反应式(半反应式);
③根据电极反应式确定半电池的电极材料和电解质溶液:
a.电极材料:一般活泼金属作负极,不活泼金属(或非金属导体)作正极;
b.电解质溶液:负极电解液一般是负极金属对应的阳离子的溶液;正极电解液一般是氧化剂对应的电解质溶液。
(2)比较金属的活动性强弱
一般来说,作负极的金属的活动性强于正极金属。
如:有两种金属a和b,用导线连接后插入稀硫酸中,观察到a极溶解,b极上有气泡产生。由此可判断出a是负极、b是正极,且金属活动性:a>b。
(3)加快化学反应速率
氧化还原反应形成原电池时,反应速率加快。在锌与稀H2SO4反应时加入少量CuSO4溶液,CuSO4与锌发生置换反应生成Cu,从而形成Cu-Zn微小原电池,加快产生H2的速率。
(4)用于金属的防护:将需要保护的金属制品作原电池的正极而受到保护。