一、HNO3为什么不能氧化Cl-?
硝酸HNO3是强氧化剂,Cl-氯离子是还原剂,但是我们知道硝酸HNO3不能氧化Cl-氯离子,可以说硝酸HNO3的氧化性不够强,也可以说Cl-的还原性还不够强。那么酸性KMnO4为什么可以氧化Cl-?下面我们通过电极电势来说明原因。
1、已知电极电势计算电动势
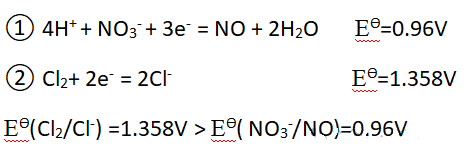
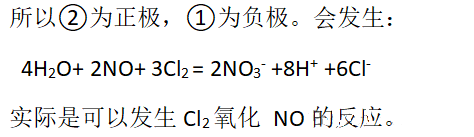

2、假如HNO3可以氧化Cl-


结论:
总之,想要发生自发的氧化还原反应,还得看电极电势,(氧化剂/还原产物)的电极电势需要更高一些,使得电动势为正值,ΔG为负,Kϴ也大一些,反应才有发生的趋势。
通常来说,我们常用Eϴ池是否大于0.2~0.4来判断氧化还原反应是否自发进行。
总结:
我们知道王水的成分是浓硝酸和浓盐酸,它们的共存证明未发生氧化还原反应,从这个事实可以记忆HNO3不能氧化Cl-。
当然我们计算按照的是标准浓度的标准电动势,浓度改变,电极电势和电动势也会发生变化,需要用能斯特方程进行修正,这里只是以标准浓度进行的判断。
这种计算方法也适用于判断其他氧化还原反应是否发生。
以下是一些常见物质的标准电极电势:
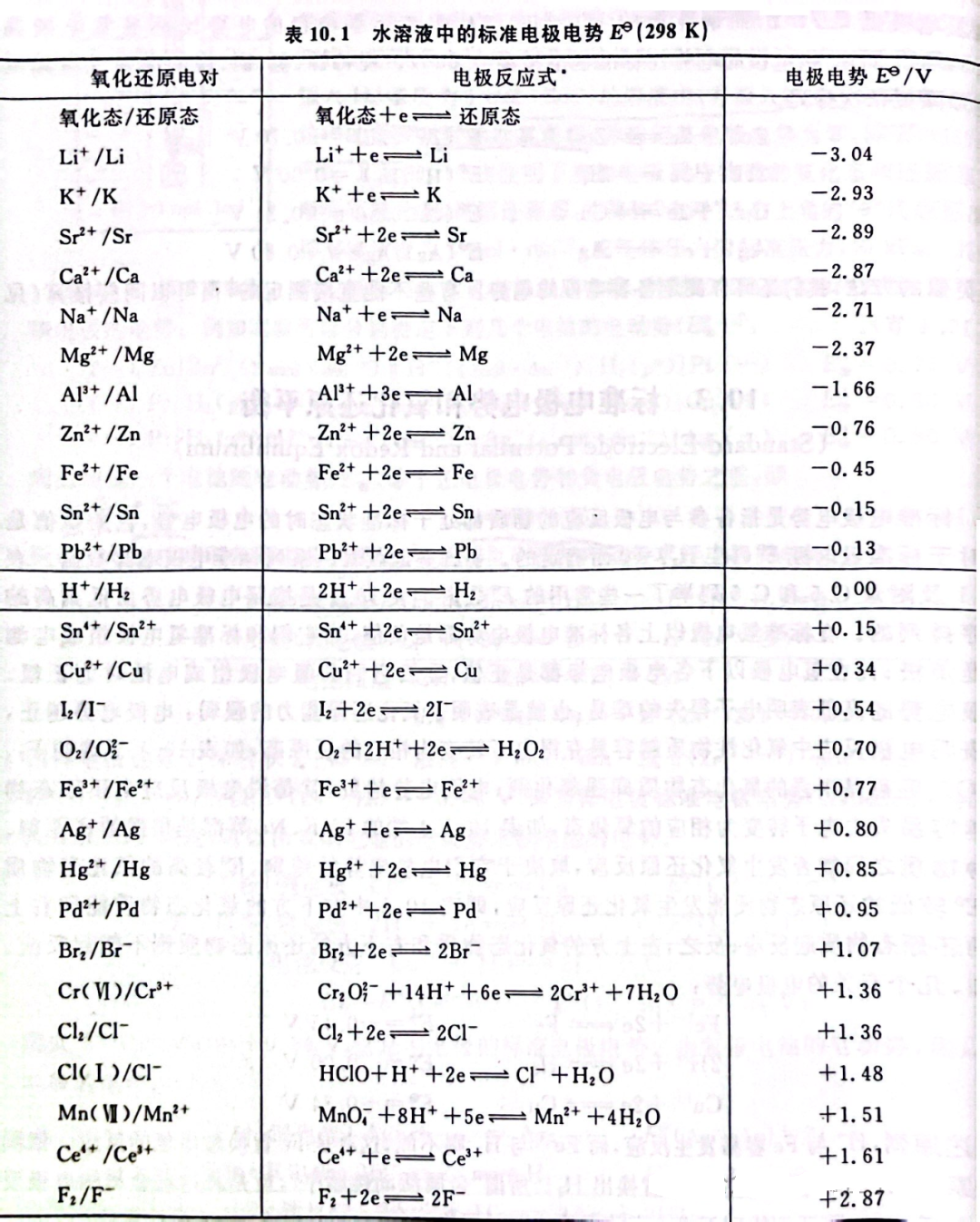
由图中可以看出Eϴ(MnO4-/Mn2+)电对的电极电势高于Eϴ(Cl2/Cl-),且Eϴ(MnO4-/Mn2+)-Eϴ(Cl2/Cl-)=1.51-1.36=0.15V,所以酸性KMnO4可以氧化Cl-。