一、盖斯定律
1、盖斯定律:一个化学反应,不管是一步 完成的还是分几步完成的,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的 途径无关。
2、盖斯定律的计算方法
(1)“虚拟路径”法:若反应物A变为生成物D,可以有两个途径。
①由A直接变成D,反应热为ΔH;
②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:

则有ΔH=ΔH1+ΔH2+ΔH3 。
(2)加合法:加合法就是运用所给热化学方程式通过 加减乘除 的方法得到所求的热化学方程式。
例:根据如下两个反应,选用上述两种方法,计算出C(s)+ O2(g)=CO(g)的反应热ΔH。
O2(g)=CO(g)的反应热ΔH。
Ⅰ:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ:CO(g)+ O2(g)=CO2(g) ΔH2=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH2=-283.0 kJ·mol-1
反应C(s)+O2(g)=CO2(g)的途径可设计如下:
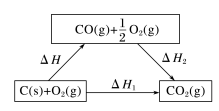
则ΔH=ΔH1-ΔH2=-110.5kJ·mol-1。
二、反应热的计算
1、根据热化学方程式计算
热化学方程式中反应热数值与各物质的化学计量数成正比。例如,
aA(g)+bB(g)=cC(g)+dD(g) ΔH
a b c d |ΔH|
n(A) n(B) n(C) n(D) Q
则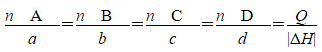
2、根据反应物、生成物的键能计算
ΔH=反应物的键能总和-生成物的键能总和。
3、根据物质的燃烧热数值计算
Q(放)=n(可燃物)×|ΔH(燃烧热)|。
4、根据盖斯定律计算
将两个或两个以上的热化学方程式包括其ΔH相加或相减 ,得到一个新的热化学方程式及其ΔH。
5、ΔH大小比较时注意事项
(1)吸热反应的ΔH为“+”,放热反应的ΔH为“-”,所以 吸热反应 的ΔH一定大于 放热反应 的ΔH。
(2)放热反应的ΔH为“-”,所以放热越多,ΔH越小。