反应热与焓变
1、内能
内能是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。
3、焓与焓变
(1)焓(H):是一个与内能有关的 物理量 。
(2)焓变(ΔH):在恒压下,化学反应过程中 吸收或释放 的热量称为该反应的焓变。常用单位kJ/mol 或 kJ·mol-1。
(3)反应热与焓变的关系
在 等压 条件下进行的化学反应的反应热等于反应的 焓变 ,因此常用 ΔH表示反应热。
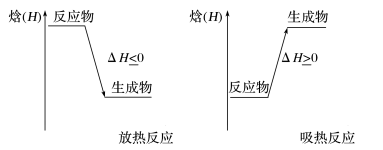
(4)焓变与吸热反应和放热反应的关系
①放热反应:反应体系向环境 释放 能量,反应体系的焓 减小 ,ΔH为负值,即ΔH<0。
②吸热反应:反应体系从环境中 吸收 能量,反应体系的焓 增大 ,ΔH为正值,即ΔH>0。
4、从微观角度理解反应热的实质
以H2(g)+Cl2(g)=2HCl(g)反应的能量变化为例说明,如图所示:
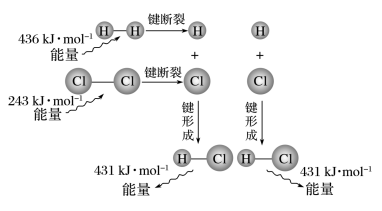
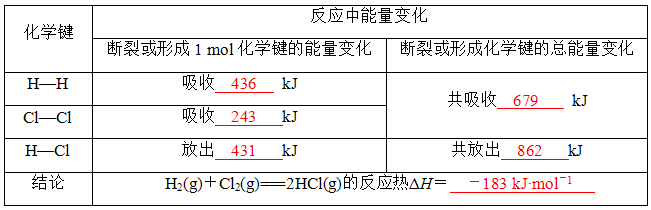
由图可知:
①图示:化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:
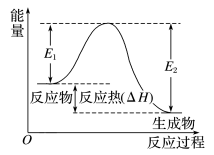
其中, E1表示反应物断裂化学键吸收的总热量, E2表示生成物形成化学键放出的总热量,E1与E2的差值表示 反应热 。上述反应过程表示该反应为 放热反应。
②焓变计算公式:ΔH=E总(断键)-E总(成键)