
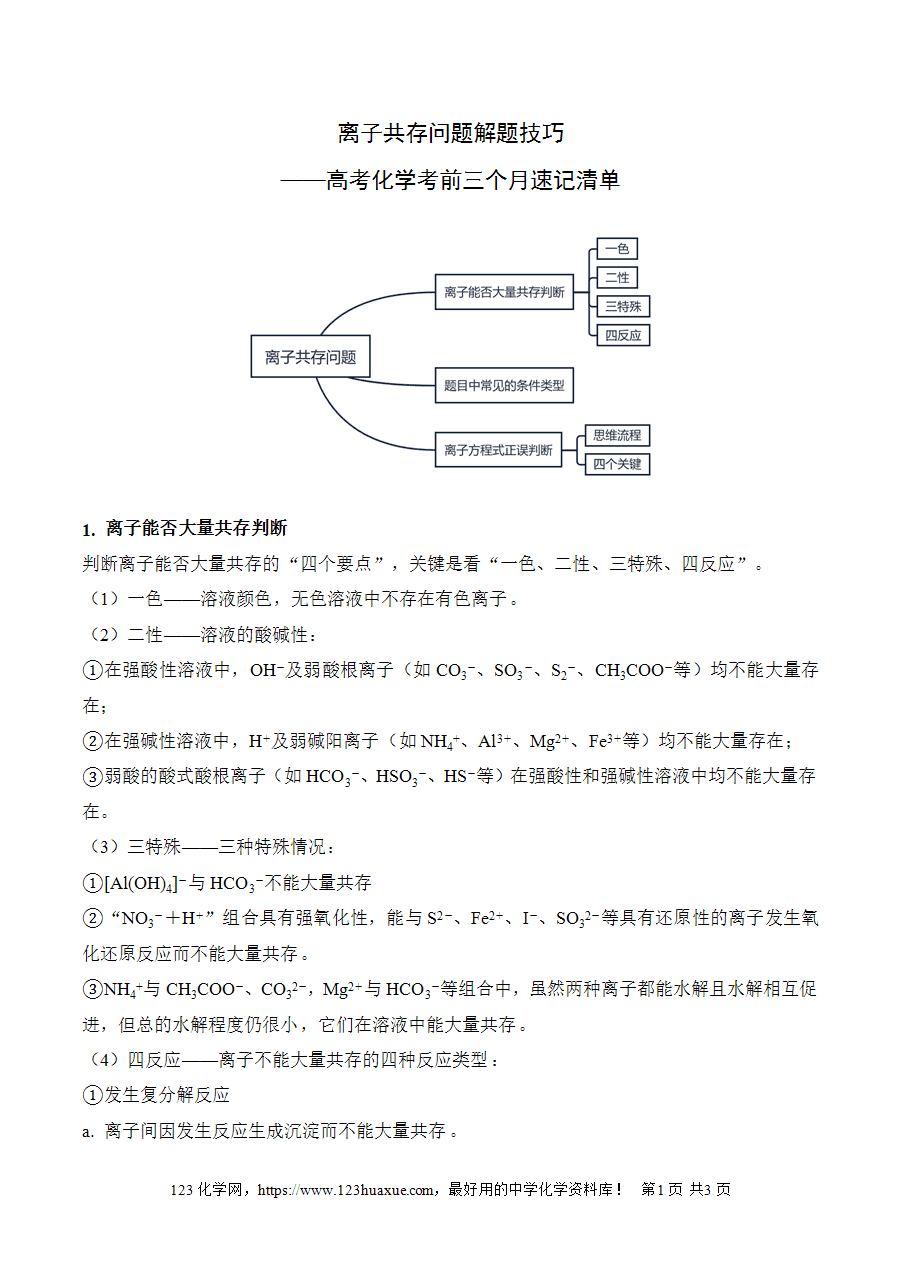
1. 离子能否大量共存判断
判断离子能否大量共存的“四个要点”,关键是看“一色、二性、三特殊、四反应”。
(1)一色——溶液颜色,无色溶液中不存在有色离子。
(2)二性——溶液的酸碱性:
①在强酸性溶液中,OH-及弱酸根离子(如CO3-、SO3-、S2-、CH3COO-等)均不能大量存在;
②在强碱性溶液中,H+及弱碱阳离子(如NH4+、Al3+、Mg2+、Fe3+等)均不能大量存在;
③弱酸的酸式酸根离子(如HCO3-、HSO3-、HS-等)在强酸性和强碱性溶液中均不能大量存在。
(3)三特殊——三种特殊情况:
①[Al(OH)4]-与HCO3-不能大量共存
②“NO3-+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SO32-等具有还原性的离子发生氧化还原反应而不能大量共存。
③NH4+与CH3COO-、CO32-,Mg2+与HCO3-等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中能大量共存。
(4)四反应——离子不能大量共存的四种反应类型:
①发生复分解反应
a. 离子间因发生反应生成沉淀而不能大量共存。


资料标签:
离子共存