专练38 金属的腐蚀与防护
1.[2024·湖北卷]2024年5月8日,我国第三艘航空母舰福建舰顺利完成首次海试。舰体表面需要采取有效的防锈措施,下列防锈措施中不形成表面钝化膜的是( )
A.发蓝处理 B.阳极氧化
C.表面渗镀 D.喷涂油漆
答案:D
解析:发蓝处理是将钢在空气中加热或直接浸在浓氧化性溶液中,使其表面产生极薄的氧化物膜的材料保护技术,故A不符合题意;阳极氧化是使阳极材料表面形成一层氧化膜的过程,B不符合题意;表面渗镀是向金属中渗入一种或几种元素以在表面形成一层扩散合金层,C不符合题意;喷涂油漆是利用油漆隔绝空气中的水蒸气和氧气,不形成表面钝化膜,D符合题意。
2.[2024·浙江1月]破损的镀锌铁皮在氨水中发生电化学腐蚀,生成[Zn(NH3)4]2+和H2,下列说法不正确的是( )
A.氨水浓度越大,腐蚀趋势越大
B.随着腐蚀的进行,溶液的pH变大
C.铁电极上发生的电极反应式为:2NH3+2e-===H2↑+2NH
D.每生成标准状况下224 mL H2,消耗0.010 mol Zn
答案:C
解析:Zn比Fe活泼,在氨水中二者可形成原电池,电化学腐蚀的总反应方程式为Zn+4NH3·H2O===[Zn(NH3)4]2++H2↑+2H2O+2OH-,氨水浓度越大,生成[Zn(NH3)4]2+的速率越快,腐蚀趋势越大,A项正确;总反应方程式中有OH-生成,故溶液pH变大,B项正确;Zn生成[Zn(NH3)4]2+,发生氧化反应,作负极,则Fe作正极,正极上水解离出来的H+得电子生成氢气,结合电解液为氨水知,Fe电极上发生的电极反应式为2H2O+2e-===H2↑+2OH-,C项错误;根据总反应方程式,可得关系式:H2~Zn,故每生成标准状况下224 mL(0.010 mol) H2,消耗0.010 mol Zn,D项正确。
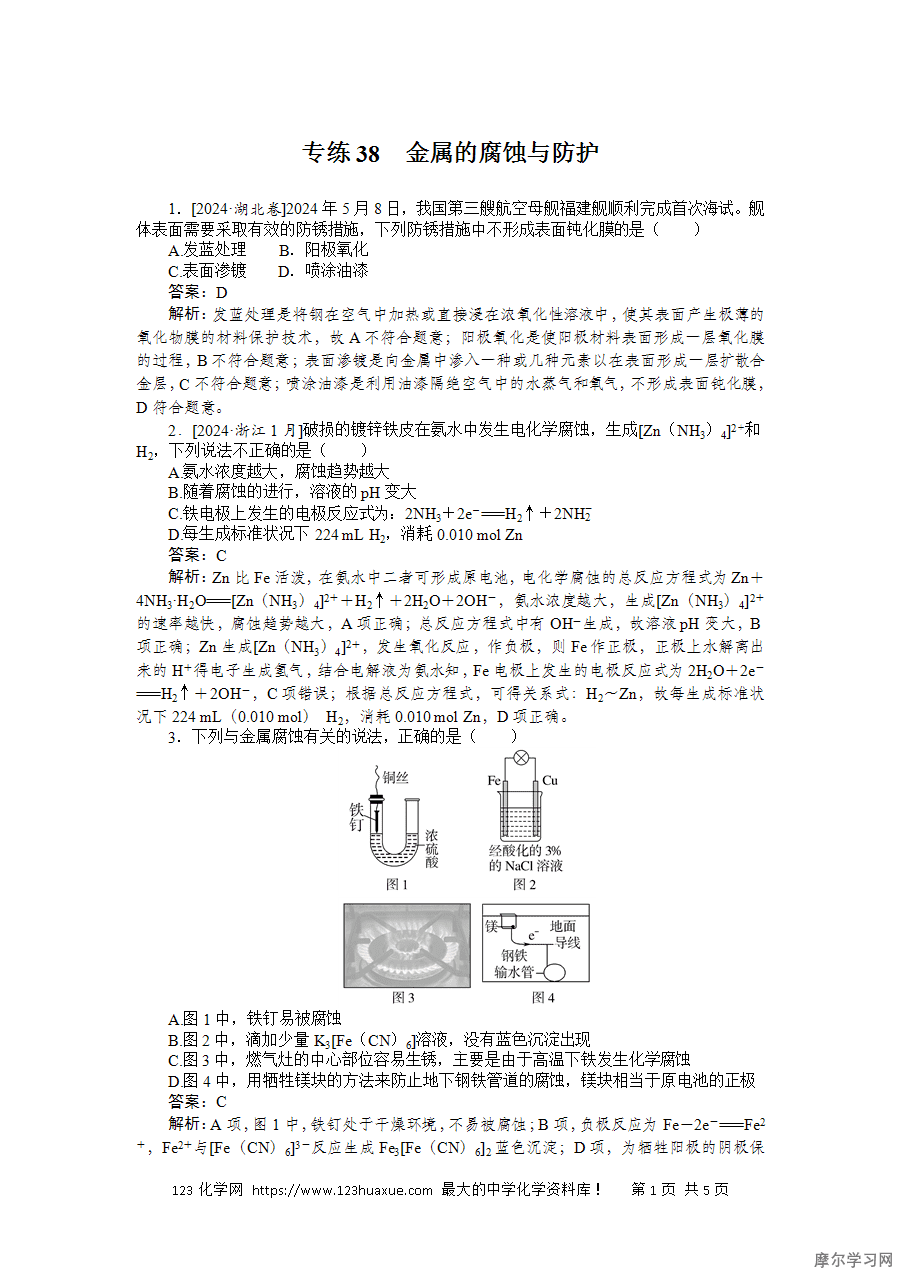
3.下列与金属腐蚀有关的说法,正确的是( )