






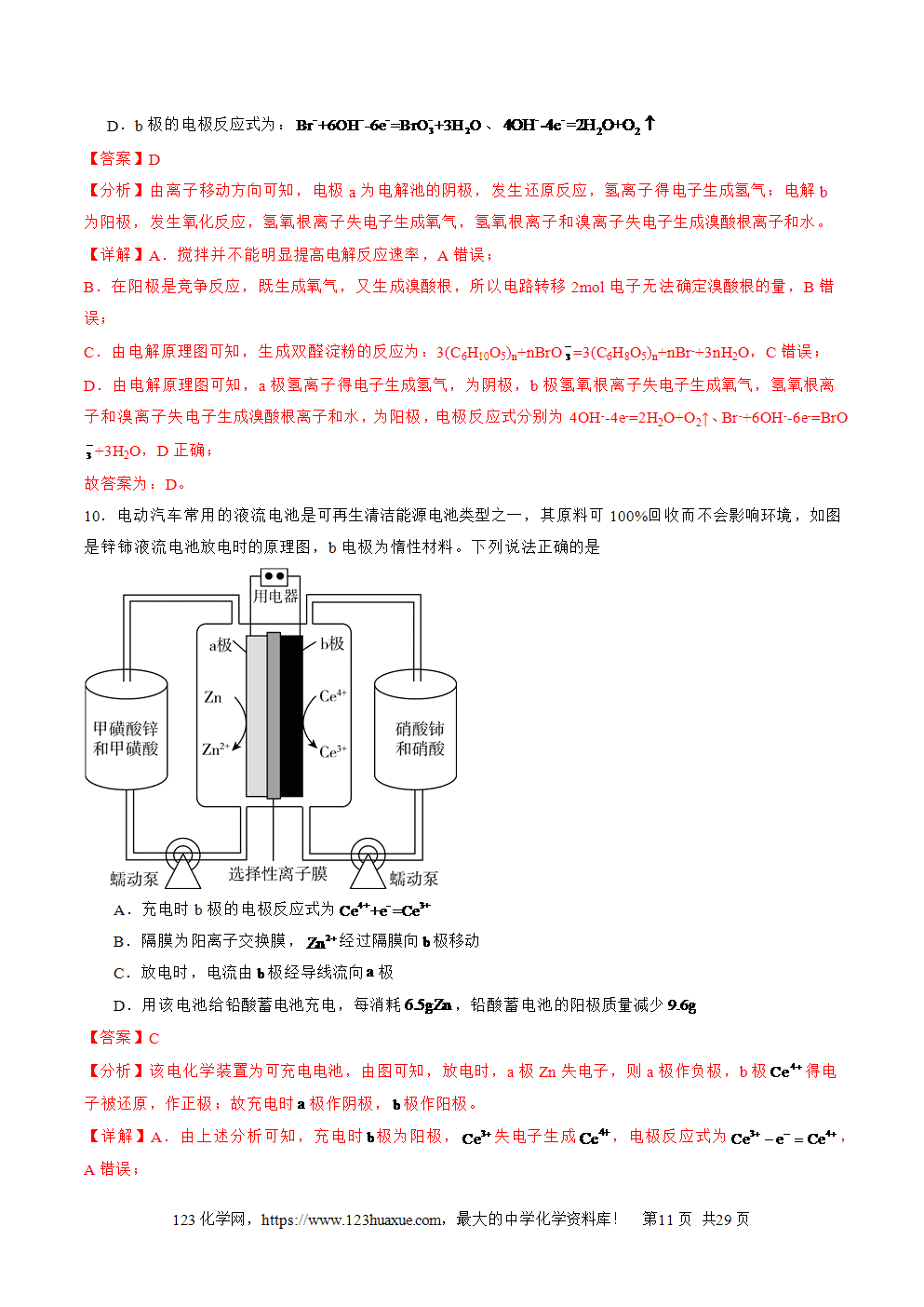

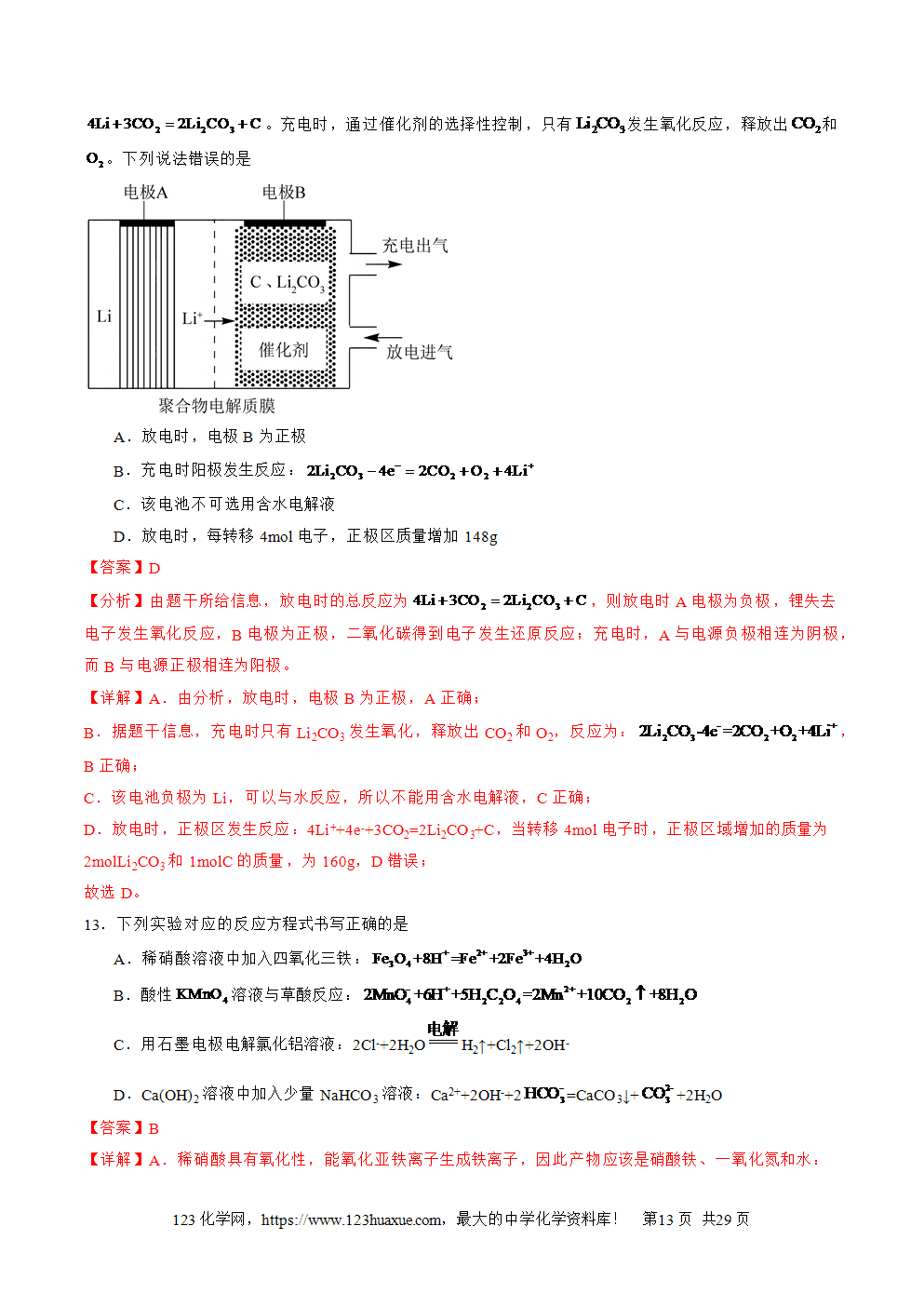





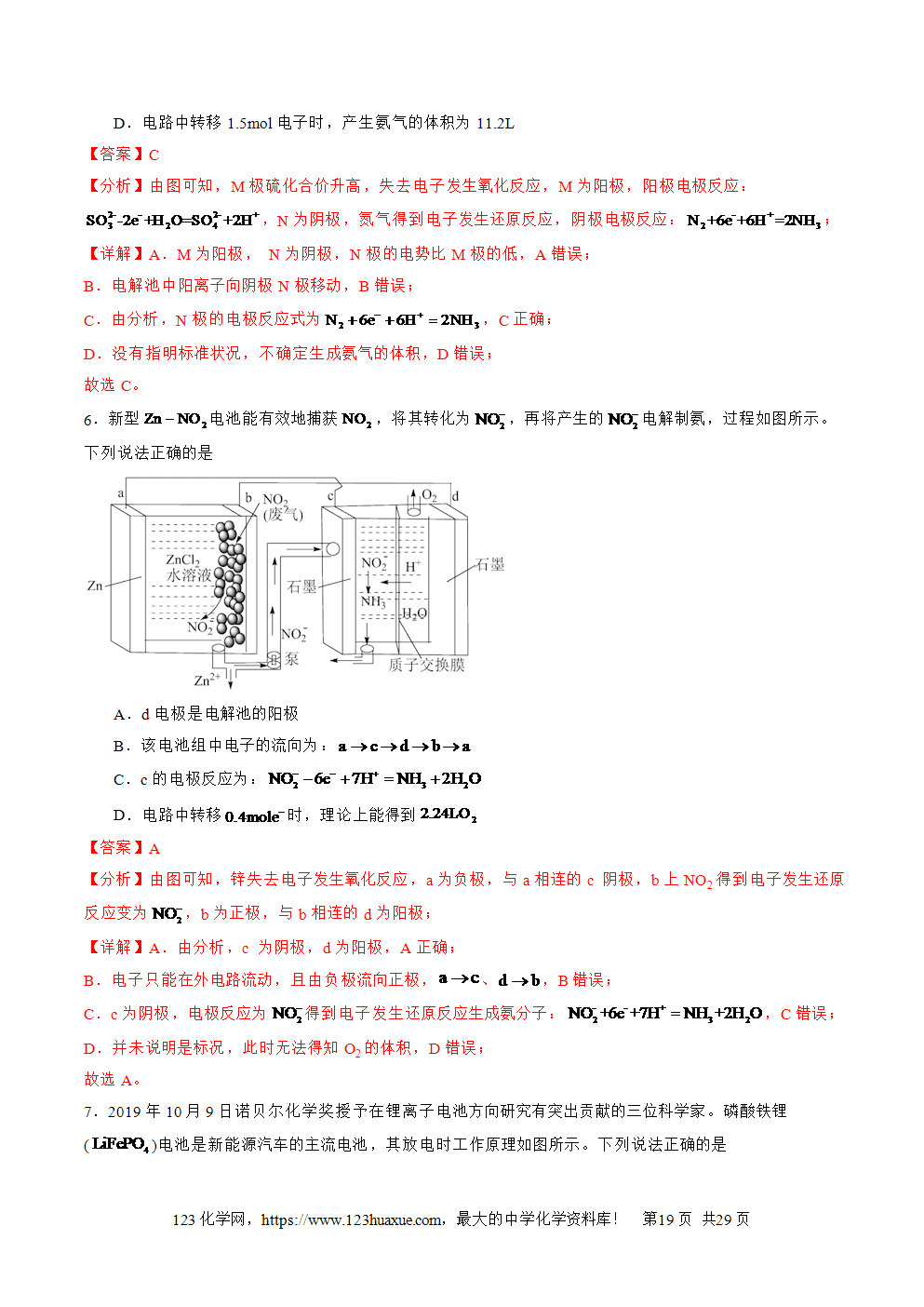
1.电解池的工作原理
(1)电极名称及电极反应式(电解CuCl2溶液为例)
总反应式:CuCl2电解(=====)Cu+Cl2↑
(2)电解过程的三个流向
①电子流向:电源负极→电解池阴极;电解池的阳极→电源的正极;
②离子流向:阳离子→电解池的阴极,阴离子→电解池的阳极。
③电流方向:电源正极→电解池阳极→电解质溶液→电解池阴极→电源极。
2.电极产物判断
(1)阳极产物的判断
①活性电极(除Au、Pt以外的金属材料作电极),电极材料失电子,生成金属阳离子。
②惰性电极(Pt、Au、石墨),要依据阴离子的放电顺序加以判断。
阴离子的放电顺序:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。S2-、I-、Br-、Cl-放电,产物分别是S、I2、Br2、Cl2;若OH-放电,则得到H2O和O2。
(2)阴极产物的判断
直接根据阳离子放电顺序进行判断。
阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+。
①若金属阳离子(Fe3+除外)放电,则得到相应金属单质;若H+放电,则得到H2。
②放电顺序本质遵循氧化还原反应的优先规律,即得(失)电子能力强的离子先放电。
3.电极反应式、电解方程式的书写
(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴离子、阳离子两组(不要忘记水溶液中的H+和OH-)。
(3)然后排出阴、阳两极的放电顺序:
阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。