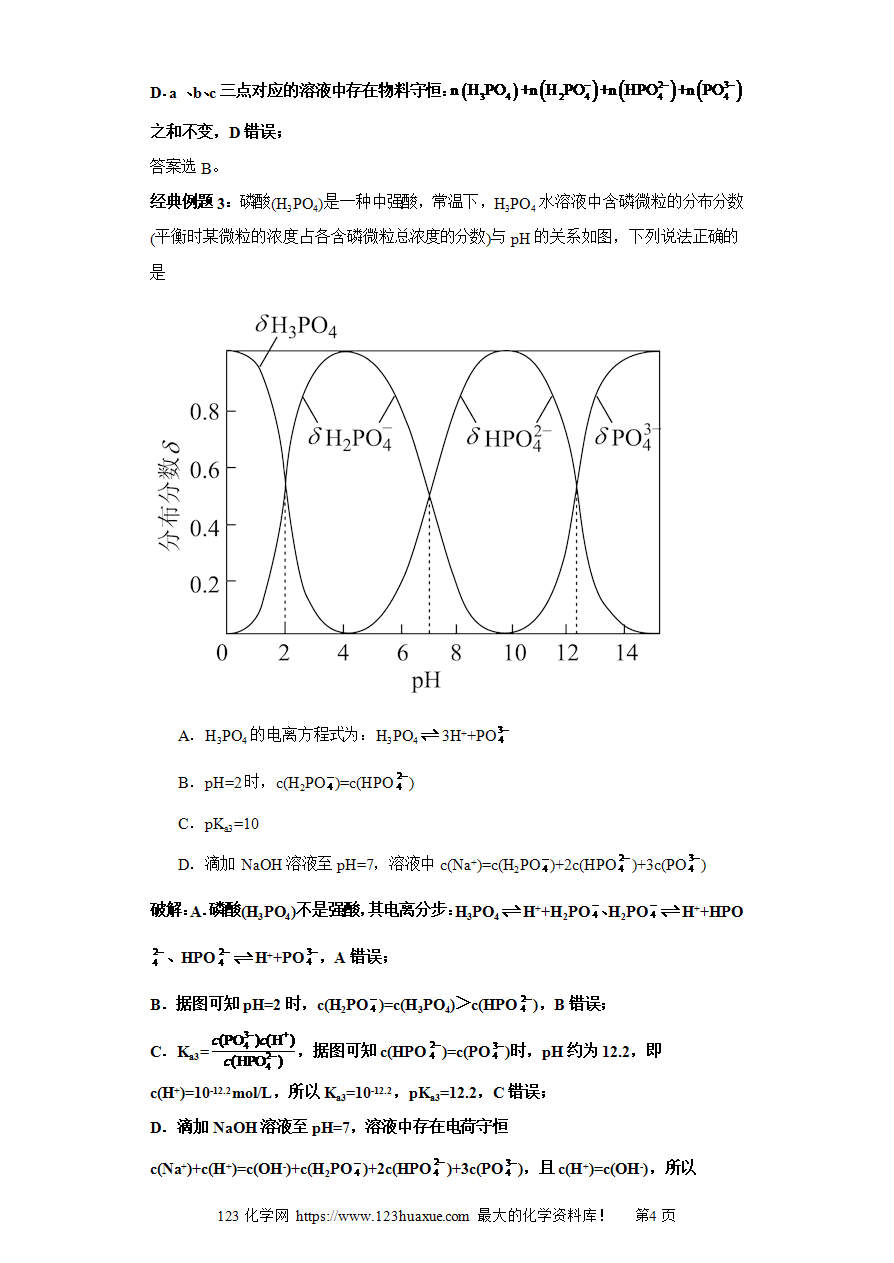
三元弱酸的分布系数图及分析(图像4秒杀)-2025年高考化学选择压轴题图像专项突破秒杀技巧及专项练习
(解析版)
三元弱酸的分布系数图及分析秒杀思想
模型:特征:指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线
以“弱酸H3A”为例
δ0为H3A分布系数、δ1为H2A-分布系数、δ2为HA2-分布系数、δ3为A3-分布系数
关键要点分析
①当溶液的pH=2时δ0=δ1,pH=7.1时δ1=δ2,pH=12.2时δ2=δ3;当pH<2时,H3A占优势;当2<pH<7.1时,H2A-占优势;当7.1<pH<12.2时,HA2-占优势;当pH>12.2时,A3-为主要存在形式
②根据分布系数可以书写一定pH时所发生反应的离子方程式,pH由11到14发生反应的离子方程式:HA2-+OH-===A3-+H2O
③根据在一定pH的微粒分布系数和酸的分析浓度,就可以计算各成分在该pH时的平衡浓度
特别注意:利用曲线的两个交点可以分别求出弱酸的Ka1=c(H+)=10-2、Ka2=c(H+)=10-7.1、Ka3=c(H+)=10-12.2
NaH2A酸碱性的方法
方法1:δ1为H2A-分布系数,当最大时可以认为全部是NaH2A,此时横坐标为酸性,可以判定NaH2A溶液显酸性
方法2:利用Ka1和Ka2,比较NaH2A的水解常数Kh=和电离常数Ka2的相对大小,即可判断NaHA溶液显酸性
经典例题1:水体中的As(V)可转化为Ca3(AsO4)2沉淀除去, As(Ⅲ)可用碘水氧化为As(Ⅴ)后,再转化为Ca3(AsO4)2沉淀除去,已知Ksp[Ca3(AsO4)2]=1×10-21.2、Ksp[Ca(CO3)]=1×10-8.6;H3AsO4水溶液中含砷的各物种的分布分数与pH的关系分别如下图所示。下列说法正确的是