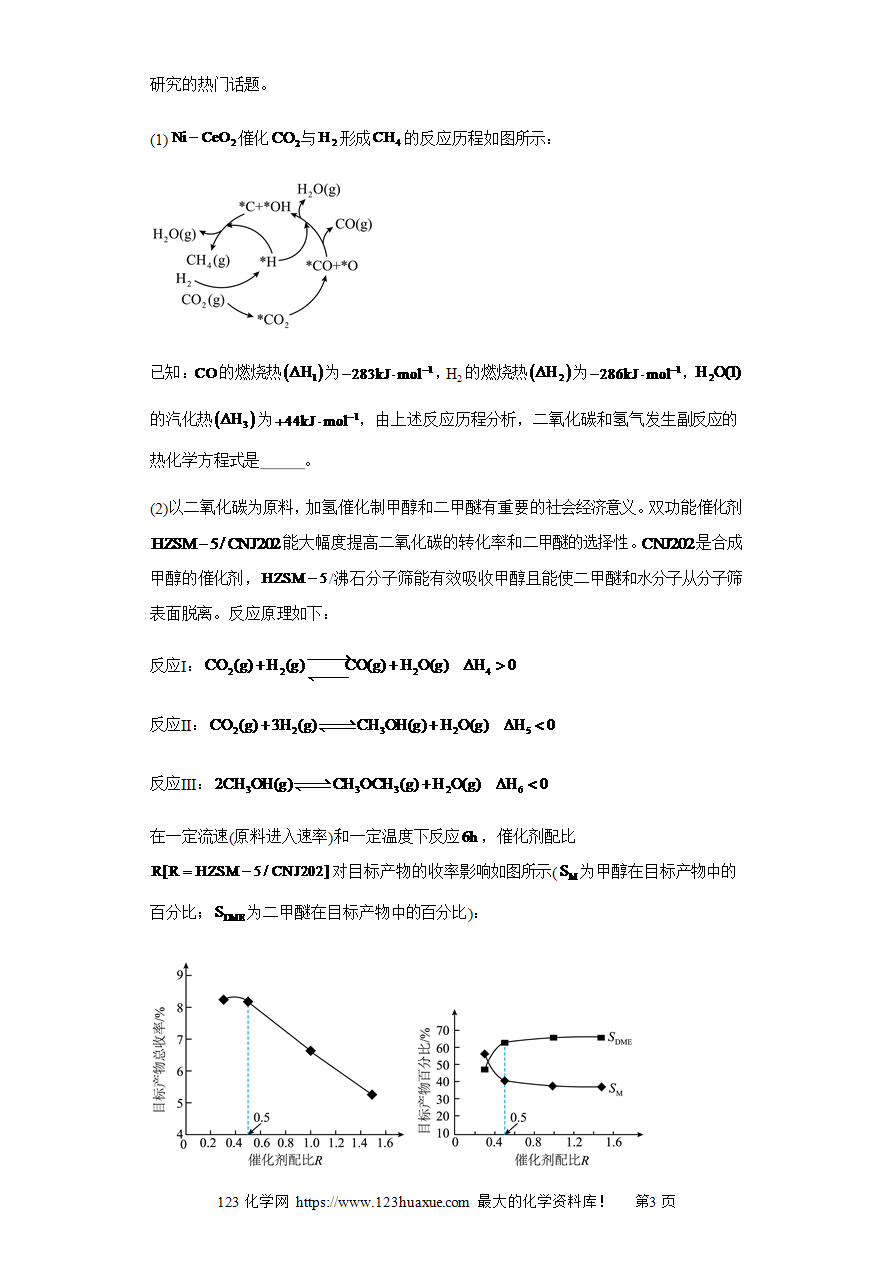
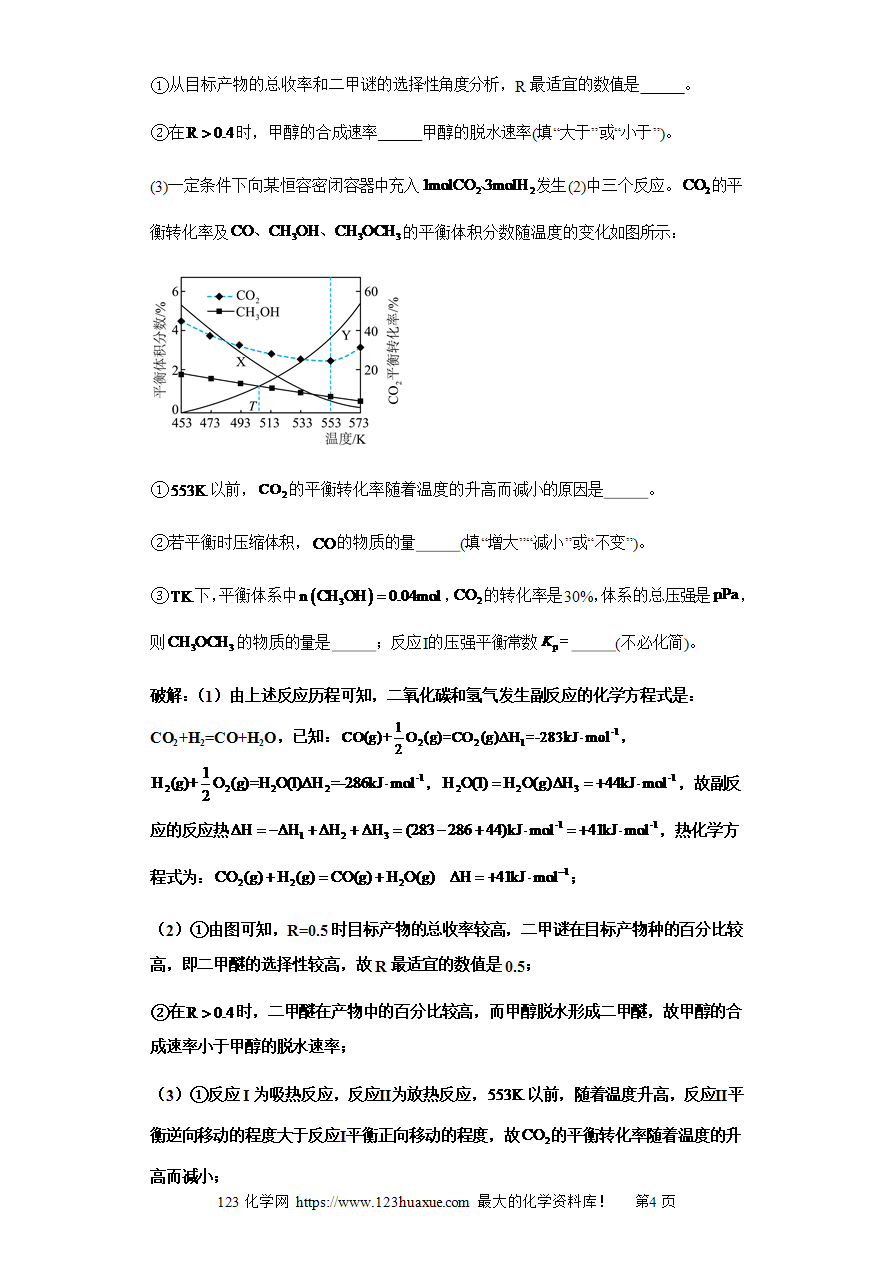
反应历程(“环式”反应)图及分析(图像14秒杀)-2025年高考化学选择压轴题图像专项突破秒杀技巧及专项练习(解析版)
反应历程(“环式”反应)图及分析秒杀思想
模型:特征:许多化学反应,尽管其反应方程式很简单,却不是基元反应,而是经由两个或多个步骤完成的复杂反应。
基元反应:大多数化学反应都是分几步完成的,其中的每一步反应都称为基元反应。对于基元反应aA+bB===gG+hH,其速率方程可写为v=k·ca(A)·cb(B)(其中k称为速率常数,恒温下,k不因反应物浓度的改变而变化),这种关系可以表述为基元反应的化学反应速率与反应物浓度以其化学计量数为指数的幂的乘积成正比。
模型:“环式”反应
关键要点分析
对于“环式”反应过程图像,
①位于“环上”的物质一般是催化剂或中间体,如⑤、⑥、⑦和⑧,“入环”的物质为反应物,如①和④
②“出环”的物质为生成物,如②和③
催化剂与中间产物
关键要点分析
催化剂:(重点)在连续反应中从一开始就参与了反应,在最后又再次生成,所以仅从结果上来看似乎并没有发生变化,实则是消耗多少后续又生成了多少。
中间产物:在连续反应中为第一步的产物,在后续反应中又作为反应物被消耗,所以仅从结果上来看似乎并没有生成,实则是生成多少后续有消耗多少。
上图中在含少量 I-的溶液中,H2O2 分解的机理为:
H2O2 + I- → H2O + IO- 慢
H2O2 + IO-→ O2 + I- +H2O 快
在该反应中I-为催化剂, IO-为中间产物。
而在机理图中,先找到确定的反应物,反应物一般是通过一个箭头进入整个历程的物质,(产物一般多是通过一个箭头最终脱离这个历程的物质)与之同时反应的就是催化剂,并且经过一个完整循环之后又会生成;中间产物则是这个循环中的任何一个环节。如下图中,MoO3则是该反应的催化剂,图中剩余的三个物质均为中间产物。
催化反应机理题的解题思路(找准一“剂”三“物”)
①一“剂”指催化剂:催化剂在机理图中多数是以完整的循环出现的,以催化剂粒子为主题的多个物种一定在机理图中的主线上
②三“物”指反应物、生成物、中间物种(或中间体)
反应物:通过一个箭头进入整个历程的物质一般是反应物
生成物:通过一个箭头最终脱离整个历程的物质多是产物
中间体:通过一个箭头脱离整个历程,但又生成的是中间体,通过两个箭头进入整个历程的中间物质也是中间体,中间体有时在反应历程中用“[ ]”标出