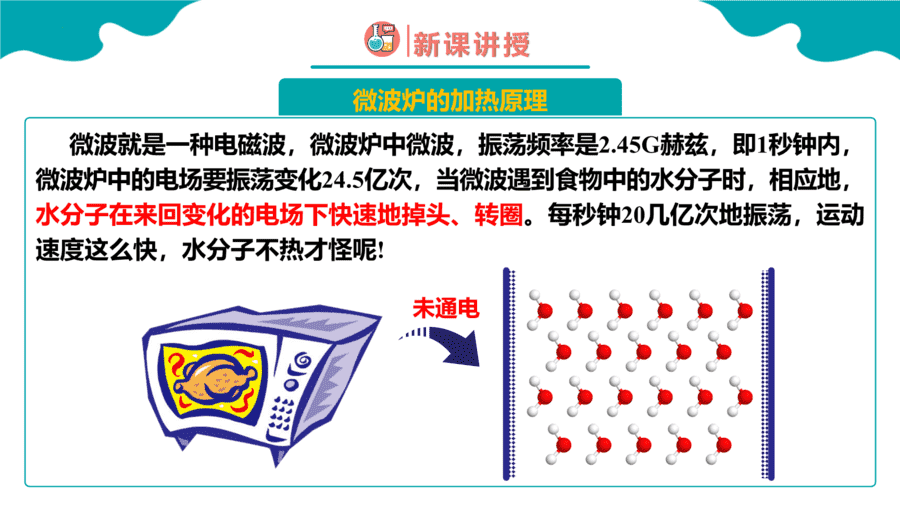
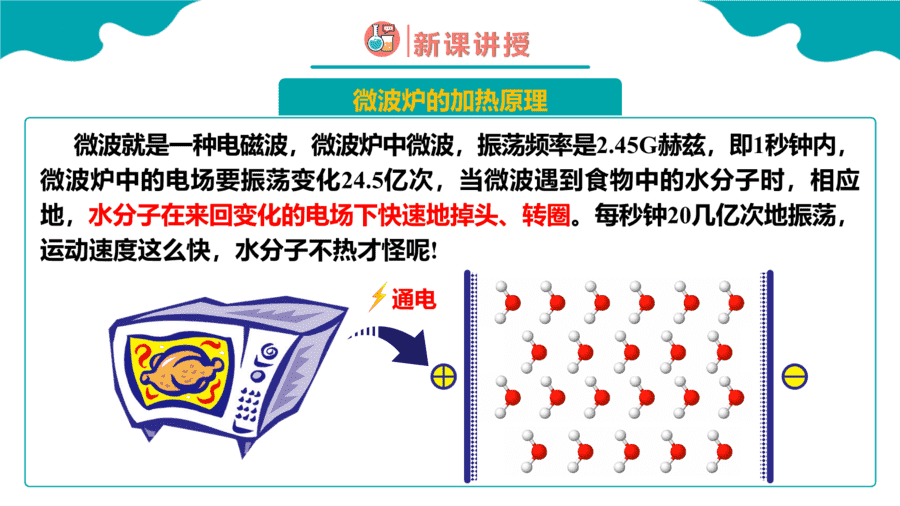
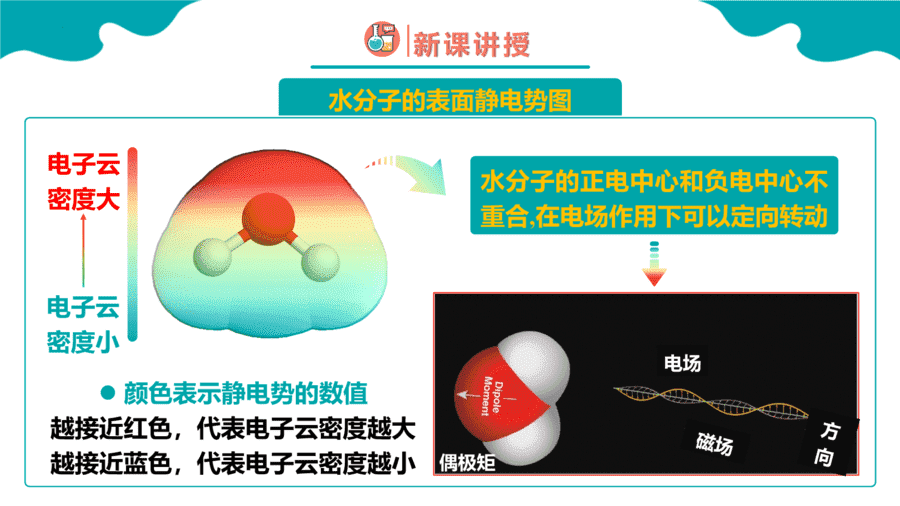
1.硒()和碲()的单质及其化合物在电子、冶金、材料等领域有广阔的发展前景,下列说法正确的是
A.是非极性分子
B.与微粒中的O-S-O夹角相等
C.硒原子基态核外价电子排布式为
D.ⅥA族元素氢化物的熔沸点从上到下依次增大
【答案】C
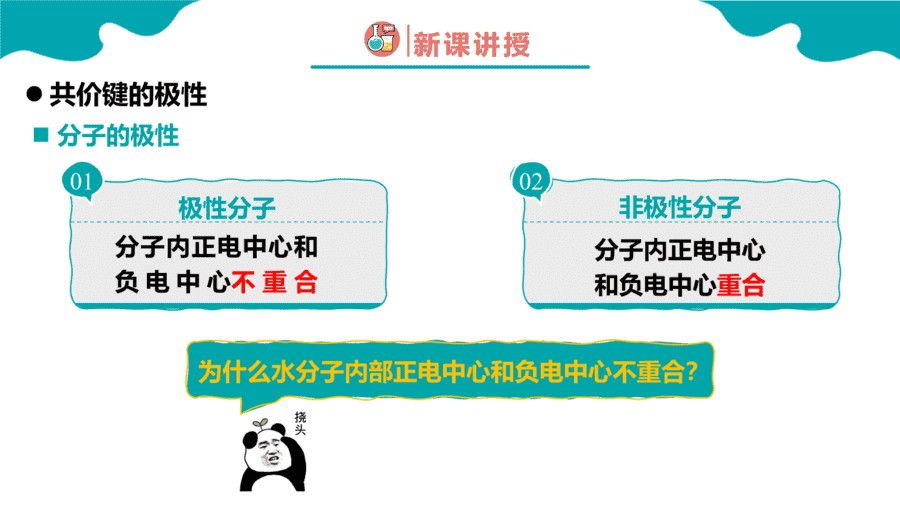
【详解】A.分子结构不对称,正负电荷中心不重叠,属于极性分子,故A错误;
B.与微粒中的中心S原子轨道的杂化方式分别是sp2和sp3,键角不一样,故B错误;
C.硒原子基态核外价电子排布式为,故C正确;
D.ⅥA族元素氢化物的沸点(除水外)从上到下依次增大,但水分子之间可以形成氢键,导致沸点是氢化物中最高的,故D错误;
故选C。
2.下列分子属于极性分子的是
A. B. C. D.
【答案】C
【详解】A.CS2分子构型为直线型,正负电荷重心重叠,属于非极性分子,A选项错误;
B.SCl6分子构型为正八面体,正负电荷重心重叠,属于非极性分子,B选项错误;
C.NF3分子构型为三角锥型,正负电荷重心不重叠,属于极性分子,C选项正确;
D.SiF4分子构型为正四面体,正负电荷重心重叠,属于非极性分子,D选项错误;
答案选C。
3.下列说法不正确的是
A.共价键有方向性
B.氢键有方向性
C.冰晶体中水分子的空间利用率比液态水分子的空间利用率低
D.在冰的晶体中,每个水分子周围只有六个紧邻的水分子
【答案】D
【详解】A.共价键是电子云头碰头或肩并肩形成的,具有方向性,A正确;
B.氢键是电负性强的氮、氧、氟与氢形成的,有方向性,B正确;
C.冰晶体中每个水分子沿着4个sp3杂化轨道的方向与周围4个水分子形成氢键,导致水分子的空间结构松散,其利用率比液态水分子的空间利用率低,C正确;
D.由C分析可知,在冰的晶体中,每个水分子周围只有4个紧邻的水分子,D错误;
故选D。