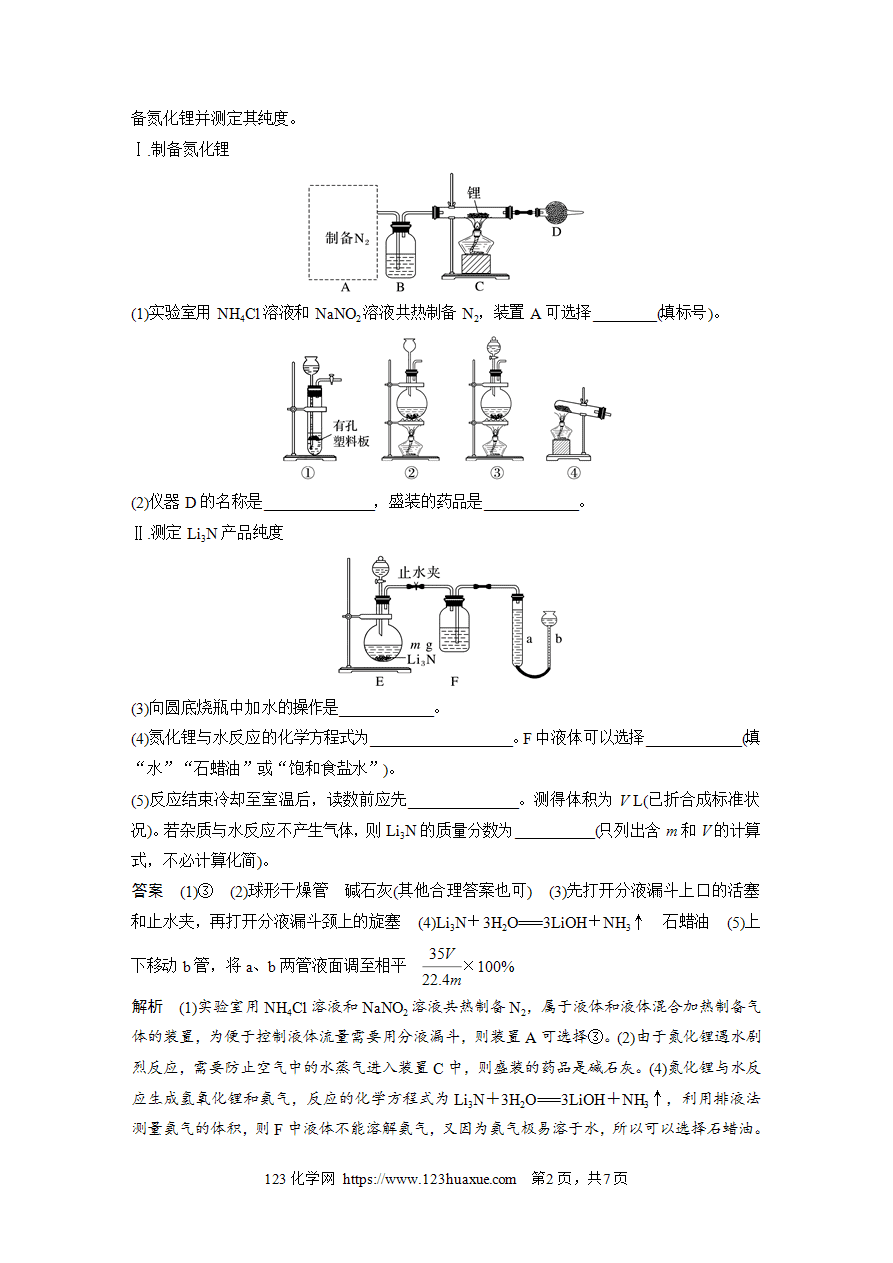
微题型94 定量实验——物质的组成、含量和产率计算
1.为测定人体血液中Ca2+的含量,设计了如下方案,有关反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O。若血液样品为15 mL,滴定生成的草酸消耗1 mmol·L-1的KMnO4溶液15.0 mL,则这种血液样品中含钙量为( )
血液样品试样(NH4(2C2O4过滤,洗涤CaC2O4稀硫酸,H2C2O4用H2SO4酸化的KMnO4溶液滴定,记录数据
A.2.5 mmol·L-1 B.1 mmol·L-1
C.0.3 mmol·L-1 D.3.5 mmol·L-1
答案 A
解析 根据反应2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O和1 mol CaC2O4生成1 mol H2C2O4,可得2KMnO4~5Ca2+,故含钙量为=2.5 mmol·L-1。
2.氮化钙(Ca3N2)是高端荧光粉的主要成分之一,其极易与水剧烈反应生成氨气。利用如图装置测定氮化钙产品纯度(杂质不产生气体,煤油可看作非极性溶剂)。下列说法正确的是