
1.(2024·湖北卷,14,3分)我国科学家设计了一种双位点PbCu电催化剂,用H2C2O4和NH2OH电化学催化合成甘氨酸,原理如图,双极膜中H2O解离的H+和OH-在电场作用下向两极迁移。已知在KOH溶液中,甲醛转化为HOCH2O-,存在平衡HOCH2O-+OH-[OCH2O]2-+H2O。Cu电极上发生的电子转移反应为[OCH2O]2--e-=HCOO-+H∙。下列说法错误的是( )
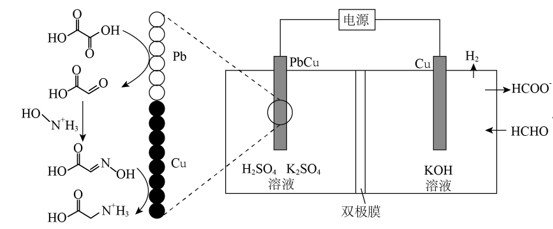
A.电解一段时间后阳极区c(OH-)减小
B.理论上生成1molH3N+CH2COOH双极膜中有4molH2O解离
C.阳极总反应式2HCHO-2e-+4OH-=2HCOO-+H2↑+2H2O
D.阴极区存在反应H2C2O4+2e-+2H+=OHC—COOH+H2O
【答案】B
【解析】在KOH溶液中HCHO转化为HOCH2O-:HCHO+OH-→HOCH2O-,存在平衡HOCH2O-+OH-[OCH2O]2-+H2O,Cu电极上发生的电子转移反应为[OCH2O]2--e-=HCOO-+H∙,H∙结合成H2,Cu电极为阳极;PbCu电极为阴极,首先HOOC—COOH在Pb上发生得电子的还原反应转化为OHC—COOH:H2C2O4+2e-+2H+=OHC—COOH+H2O,OHC—COOH与HO—N+H3反应生成HOOC—CH=N—OH:OHC—COOH+HO—N+H3→HOOC—CH=N—OH+H2O+H+,HOOC—CH=N—OH发生得电子的还原反应转化成H3N+CH2COOH:HOOC—CH=N—OH+4e-+5H+=H3N+CH2COOH+H2O。A项,电解过程中,阳极区消耗OH-、同时生成H2O,故电解一段时间后阳极区c(OH-)减小,A正确;B项,阴极区的总反应为H2C2O4+HO—N+H3+6e-+6H+= H3N+CH2COOH+3H2O,1molH2O解离成1molH+和1molOH-,故理论上生成1molH3N+CH2COOH双极膜中有6molH2O解离,B错误;C项,结合装置图,阳极总反应为2HCHO-2e-+4OH-=2HCOO-+H2↑+2H2O,C正确;D项,阴极区的Pb上发生反应H2C2O4+2e-+2H+=OHC—COOH+H2O,D正确;故选B。