
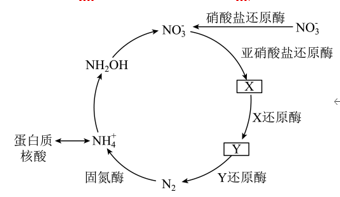
1.(2024·安徽卷,7,3分)地球上的生物氮循环涉及多种含氮物质,转化关系之一如下图所示(X、Y均为氮氧化物),羟胺(NH2OH)以中间产物的形式参与循环。常温常压下,羟胺易潮解,水溶液呈碱性,与盐酸反应的产物盐酸羟胺([NH3OH]Cl)广泛用子药品、香料等的合成。
已知25℃时,Ka(HNO2)=7.2×10-4,Kb(NH3·H2O)=1.8×10-5 ,Kb(NH2OH)=8.7×10-9。
下列有关物质结构或性质的比较中,正确的是( )
A.键角:NH3>NO3-
B.熔点: NH2OH>[NH3OH]Cl
C.同浓度水溶液的pH:[NH3OH]Cl>NH4Cl
D.羟胺分子间氢键的强弱:
【答案】D
【解析】A项,NH3中N原子的价层电子对数=,为sp3杂化,键角为107°,NO3-中N的价层电子对数=,为sp2杂化,键角为120°,故键角:NH3<NO3-,A错误;B项,NH2OH为分子晶体,[NH3OH]Cl为离子晶体,故熔点:NH2OH<[NH3OH]Cl,B错误;C项,由题目信息可知,25℃下,Kb(NH3·H2O)>Kb(NH2OH),故NH2OH的碱性比NH3·H2O弱,故同浓度的水溶液中,[NH3OH]+的电离程度大于NH4+的电离程度,同浓度水溶液的pH:[NH3OH]Cl<NH4Cl,C错误;D项,O的电负性大于N,O-H键的极性大于N-H键,故羟胺分子间资料标签: