
第19讲 铬、锰、钒、钴、镍及其化合物
【复习目标】
1.掌握铬及其化合物的性质及用途。
2.掌握锰及其化合物的性质及用途。
3.掌握钒及其化合物的性质及用途。
4.掌握钴及其化合物的性质及用途。
5.掌握镍及其化合物的性质及用途。
【知识精讲】
1.铬及其化合物
铬元素的常见价态有+6、+3、+2价。在酸性介质中,Cr2+具有强的还原性,Cr3+的还原性较弱,只有用强氧化剂才能将Cr3+氧化成Cr2O2-7,+6价铬在酸性条件下以Cr2O2-7存在,具有强氧化性,在碱性介质中以CrO2-4存在。
(1)铬(Ⅵ)最重要的化合物是K2Cr2O7,在水溶液中Cr2O2-7和CrO2-4存在下列平衡:
2CrO2-4(黄色)+2H+ Cr2O2-7(橙红色)+H2O
在酸性溶液中,Cr2O2-7具有强氧化性,如可以氧化浓盐酸,生成氯气:
Cr2O2-7+6Cl-+14H+===2Cr3++3Cl2↑+7H2O
但在碱性溶液中CrO2-4的氧化性要弱得多。
(2)Cr(Ⅲ)在酸性条件下以Cr3+存在,碱性条件下以Cr(OH)3、[Cr(OH)4]-(或CrO-2)存在。
①Cr3+在酸性条件下是稳定的,只能被强氧化剂氧化,如:
2Cr3++3PbO2+H2O===3Pb2+ +Cr2O2-7+2H+。
但在碱性条件下能被氧化成CrO2-4,2Cr3++3H2O2+10OH-===2CrO2-4+8H2O。
②在碱性溶液中,CrO-2可以被H2O2氧化为CrO2-4,2CrO-2+3H2O2+2OH-===2CrO2-4+4H2O。
【例题1】以某冶金工业产生的废渣(含Cr2O3、SiO2及少量的Al2O3)为原料,根据下列流程可制备K2Cr2O7。
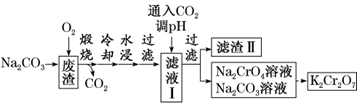
下列说法正确的是( )
A.煅烧时没有发生氧化还原反应
B.滤渣Ⅱ中主要成分是Al(OH)3
C.可循环使用的物质是CO2和Na2CO3
D.由Na2CrO4转化为K2Cr2O7的过程中需加入KOH
【答案】C
【解析】