
第39讲 酸碱中和滴定、氧化还原滴定、沉淀滴定
【复习目标】
1.了解酸碱中和滴定的原理和滴定终点的判断方法,知道指示剂选择的方法。
2.掌握酸碱中和滴定的操作和数据处理误差分析的方法。
3.掌握滴定法在定量测定中的应用。
【知识精讲】
考点一 酸碱中和滴定
1.实验原理
(1)用已知浓度的酸(或碱)滴定未知浓度的碱(或酸),根据中和反应的等量关系来测定酸(或碱)的浓度。
①反应实质:H++OH-===H2O。
②定量关系:恰好中和时,n(H+)=n(OH-),即c(H+)V酸=c(OH-)V碱。
(2)利用酸碱指示剂明显的颜色变化,表示反应已完全,指示滴定终点。
指示剂 变色范围的pH
石蕊 <5.0红色 5.0~8.0紫色 >8.0蓝色
甲基橙 <3.1红色 3.1~4.4橙色 >4.4黄色
酚酞 <8.2无色 8.2~10.0粉红色 >10.0红色
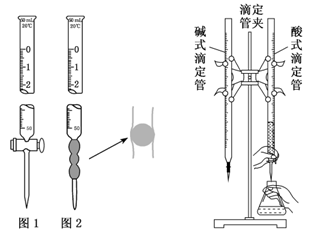
2.实验用品
(1)仪器:酸式滴定管(如图1)、碱式滴定管(如图2)、滴定管夹、铁架台、锥形瓶、烧杯。
资料标签: