
1、298K时,向20.0mL0.10mol·L-1H2A溶液中滴加0.10mol·L-1NaOH溶液,滴定曲线如图所示。下列说法正确的是( )
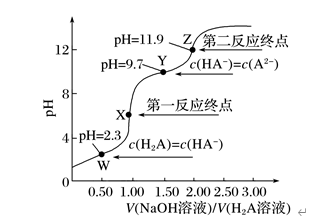
A.该滴定过程应该选择甲基橙作指示剂
B.W点到X点发生的主要反应的离子方程式为H2A+2OH-===A2-+2H2O
C.Y点对应的溶液中c(Na+)+c(H+)=c(OH-)+2c(A2-)
D.反应H2A+A2- 2HA-的平衡常数K=1.0×107.4
答案 D
解析 根据第二反应终点溶液显碱性可知H2A为弱酸,强碱滴定弱酸用碱性条件下变色的酚酞溶液作指示剂,A项错误;X点对应的溶液中溶质主要是NaHA,W点到X点发生的主要反应的离子方程式为H2A+OH-===HA-+H2O,B项错误;根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),因为Y点对应的溶液中c(HA-)=c(A2-),所以c(Na+)+c(H+)=c(OH-)+3c(A2-),C项错误;H2AHA-+H+,Ka1=cH+·cHA-cH2A,由于W点c(HA-)=c(H2A),故Ka1=c(H+)=1.0×10-2.3;HA- A2-+H+,Ka2=cH+·cA2-cHA-,由于Y点对应的溶液中c(HA-)=c(A2-),故Ka2=c(H+)=1.0×10-9.7;H2A HA-+H+与HA- A2-+H+相减即得H2A+A2- 2HA-,此时的平衡常数K=Ka1Ka2=1.0×10-2.31.0×10-9.7=1.0×107.4,D项正确。
2.常温时,用0.10 mol·L-1 NaOH溶液滴定25.00 mL 0.10 mol·L-1一元弱酸HX的溶液,滴定过程中pH变化曲线如图所示。若忽略反应过程中因液体密度变化而导致的体积变化,则下列判断正确的是( )