
电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1 为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2 为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线,温度均由22 ℃上升到70 ℃。下列判断不正确的是( )
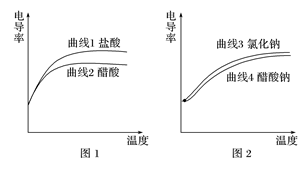
A.由曲线1可以推测:温度升高可以提高离子的迁移速率
B.由曲线4可以推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关
C.由图1和图2可以判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率
D.由图1和图2可以判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率无关
答案 D
解析 曲线1中盐酸在升高温度的过程中离子浓度不变,但电导率逐渐升高,说明温度升高可以提高离子的迁移速率,故A项正确;温度升高,促进CH3COONa溶液中CH3COO-的水解,则由曲线3和曲线4可知,温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关,故B项正确;曲线1和曲线2起始时电导率相等,但温度升高能促进醋酸的电离,溶液中离子浓度增加,但盐酸的电导率明显比醋酸高,说明可能原因是Cl-的迁移速率大于CH3COO-的迁移速率,故C项正确;曲线1和曲线2起始时电导率相等,可知盐酸和醋酸两溶液中起始时离子浓度相等,包括H+和OH-浓度也相等,而随着温度的升高,促进醋酸的电离,醋酸溶液中的H+和OH-浓度不再和盐酸的H+和OH-浓度相等,则两者的电导率升高的幅度存在差异,可能与溶液中H+、OH-的浓度和迁移速率有关,故D项错误。
2.室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙两烧杯中溶液的描述正确的是( )