
微题型11 氧化还原反应中的定量计算
1. (2021·湖南,8)KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为6I2+11KClO3+3H2O6KH(IO3)2+5KCl+3Cl2↑。下列说法错误的是( )
A.产生22.4 L(标准状况)Cl2时,反应中转移10 mol e-
B.反应中氧化剂和还原剂的物质的量之比为11∶6
C.可用石灰乳吸收反应产生的Cl2制备漂白粉
D.可用酸化的淀粉碘化钾溶液检验食盐中IO的存在
答案 A
解析 该反应中只有碘元素的价态升高,由0价升高至KH(IO3)2中的+5价,每个碘原子升高5价,即6I2~60e-,又因化学方程式中6I2~3Cl2,故3Cl2~60e-,即Cl2~20e-,所以产生22.4 L (标准状况) Cl2即1 mol Cl2时,反应中应转移20 mol e-,A错误。
2.(2022·北京模拟)以重晶石(BaSO4)为原料生产白色颜料立德粉(ZnS·BaSO4)的工艺流程如图:
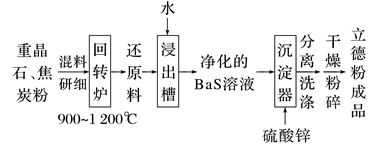
下列说法不正确的是( )
A.将重晶石研细,可加快其在回转炉中的化学反应速率
B.回转炉中每生成1 mol BaS,有4 mol e-发生转移
C.浸出槽的滤渣经处理后循环利用,可提高原料利用率
D.沉淀器中发生的反应为SO42-+Ba2++Zn2++SO===ZnS·BaSO4↓
答案 B