
[复习目标] 1.掌握配制一定物质的量浓度溶液的方法。2.掌握中和滴定的实验操作、误差分析及有关计算。3.掌握氧化还原反应、沉淀反应在滴定法中的应用。
1.溶液的配制
(1)一定物质的量浓度溶液的配制步骤
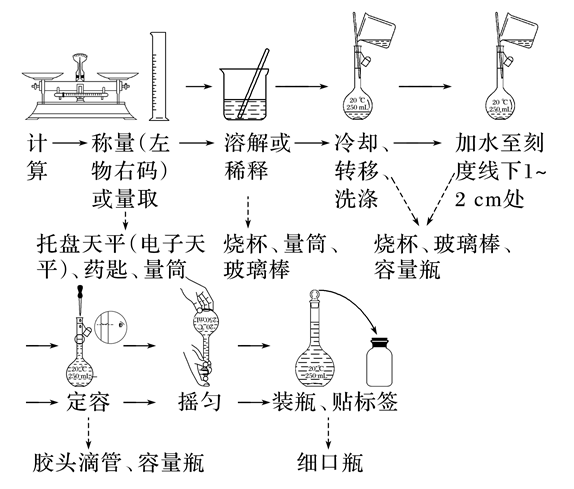
(2)配制一定质量分数溶液的步骤及仪器
步骤:计算溶质、溶剂的质量→称量或量取→搅拌、溶解→装瓶、贴标签等。
所需仪器:托盘天平(电子天平)、药匙、量筒、烧杯、玻璃棒、细口瓶。
2.“中和滴定”考点归纳
(1)实验仪器
酸式滴定管、碱式滴定管、滴定管夹(带铁架台)、锥形瓶。其中常考的是滴定管,如正确选择滴定管(包括量程),滴定管的检漏、洗涤和润洗,滴定管的正确读数方法等。
(2)操作步骤
①滴定前的准备:查漏、洗涤、润洗、充液(赶气泡)、调液面、读数;②滴定:移液、滴加指示剂、滴定至终点、读数;③计算。
(3)指示剂的选择
类型 滴定过程 指示剂 终点颜色变化
酸碱中
和反应 强酸滴定强碱(或弱碱) 甲基橙 溶液由黄色变为橙色
强碱滴定强酸(或弱酸) 酚酞 溶液由无色变为浅红色
资料标签: