
教材实验装置再现
(一)配制一定物质的量浓度的溶液
1.主要仪器
固体溶解:托盘天平、烧杯、玻璃棒、 容量瓶、胶头滴管溶液稀释:量筒、烧杯、玻璃棒、 容量瓶、胶头滴管
2.注意事项
(1)容量瓶:只有一个刻度线,只能配制瓶上规定容积的溶液,若配制480 mL溶液应用500 mL容量瓶。
(2)写所用仪器时,容量瓶必须注明规格。
(3)容量瓶使用之前必须查漏。
3.误差分析依据:cB=nBV=mBMBV。
4.命题角度:一是仪器的缺失与选择,二是实验误差分析。
(二)Fe(OH)2的制备
1.实验现象:白色沉淀迅速转变为灰绿色,最后变成红褐色沉淀。
2.反应方程式为Fe2++2OH-===Fe(OH)2↓、
4Fe(OH)2+O2+2H2O===4Fe(OH)3。
3.注意事项:Fe(OH)2具有较强的还原性,容易被氧化。
(1)所用亚铁盐溶液必须是新制的,NaOH溶液必须煮沸;
(2)胶头滴管须插入试管底部;
(3)往往在液面加一层油膜,如少量煤油、苯或植物油等,如图1;或用如图2所示改进装置。
4.命题角度:制备过程中的现象、创设无氧环境。
(三)氨气的实验室制法
1.反应原理:2NH4Cl+Ca(OH)2=====△CaCl2+2NH3↑+2H2O。
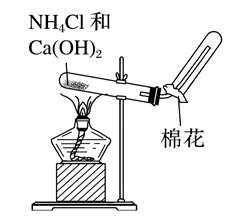
2.气体制备流程:原理——发生装置——除杂干燥——收集——验满——尾气处理。
3.注意事项
(1)制备装置中试管口要略低于试管底、收集装置中导管应插入试管底部。
(2)浓氨水(或浓铵盐溶液)滴到生石灰或烧碱中制氨气,或浓氨水直接加热也可制氨气。
(3)不能直接使用NH4Cl或NH4HCO3加热制备。
4.命题角度:物质制备原理、发生装置、除杂干燥、收集、尾气处理等,并以此基础进行性质探究实验。
(四)喷泉实验