
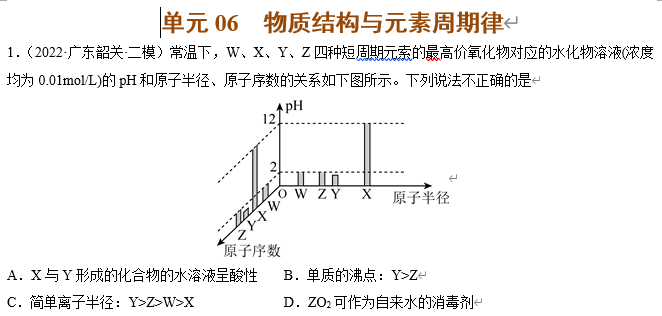
A.X与Y形成的化合物的水溶液呈酸性 B.单质的沸点:Y>Z
C.简单离子半径:Y>Z>W>X D.ZO2可作为自来水的消毒剂
【答案】A
【解析】浓度均为0.01mol•L-1的溶液,W、Y、Z的最高价氧化物对应的水化物的pH都小于7,W、Y、Z的最高价氧化物对应的水化物是酸,说明W、Y、Z都是非金属元素,W、Z最高价氧化物对应的水化物的pH=2,为一元强酸,原子序数Z>W,则Z是Cl、W是N;Y的最高价氧化物对应的水化物的pH<2,应该为二元强酸硫酸,则Y是S;X的最高价氧化物对应的水化物的pH=12,应该为一元强碱氢氧化钠,则X是Na。
由以上分析可知,W、X、Y、Z分别为N、Na、S、Cl元素,
A. X与Y形成的化合物Na2S 为强碱弱酸盐,水解后水溶液呈碱性,故A错误;
B. 硫常温下是固体,氯气为气体,单质的沸点:Y>Z,故B正确;
C. 电子层数越多,原子或离子的半径越大,电子层数相同时,核电荷数越大,对核外电子的吸引能力越强,离子半径越小,则N3-、Na+、S2-、Cl-的半径大小为:S2->Cl->N3->Na+,即Y>Z>W>X,故C正确;
D. ClO2具有强氧化性,能使蛋白质变性,可作为自来水的消毒剂,故D正确;
故选A。
2.(2022·陕西汉中·二模)短周期主族元素X、Y、Z、W的原子序数依次增大,X为字宙中含量最丰富的元素,Z原子能形成分别含10电子、18电子的两种阴离子,常温下,W的单质能溶于Y的最高价氧化物对应水化物的稀溶液,但不溶于其浓溶液。下列叙述正确的是
A.原子半径大小顺序为:W>Z>Y>X
B.气态氢化物的稳定性:Y<Z
C.Z的最高化合价为+6
D.工业上用电解W的氯化物制备其单质
【答案】B
【解析】短周期主族元素X、Y、Z、W的原子序数依次增大,X为字宙中含量最丰富的元素,则X为H元素;常温下,W的单质能溶于Y的最高价氧化物对应水化物的稀溶液,但不溶于其浓溶液,则Y为N元素、W为Al元素;Z原子能形成分别含10电子、18电子的两种阴离子, 则Z为O元素。
A.同周期元素,从左到右原子半径依次减小,则氧原子的原子半径小于氮原子,故A正确;
B.同周期元素,从左到右元素的非金属性增强,氢化物的稳定性增强,则氨气的稳定性小于水,故B正确;
C.氧元素的非金属性强,最高化合价不为+6价,故C错误;
D. 工业上用电解熔融氧化铝制备铝,不能用电解熔融氯化铝制备铝,故D错误;
故选B。