
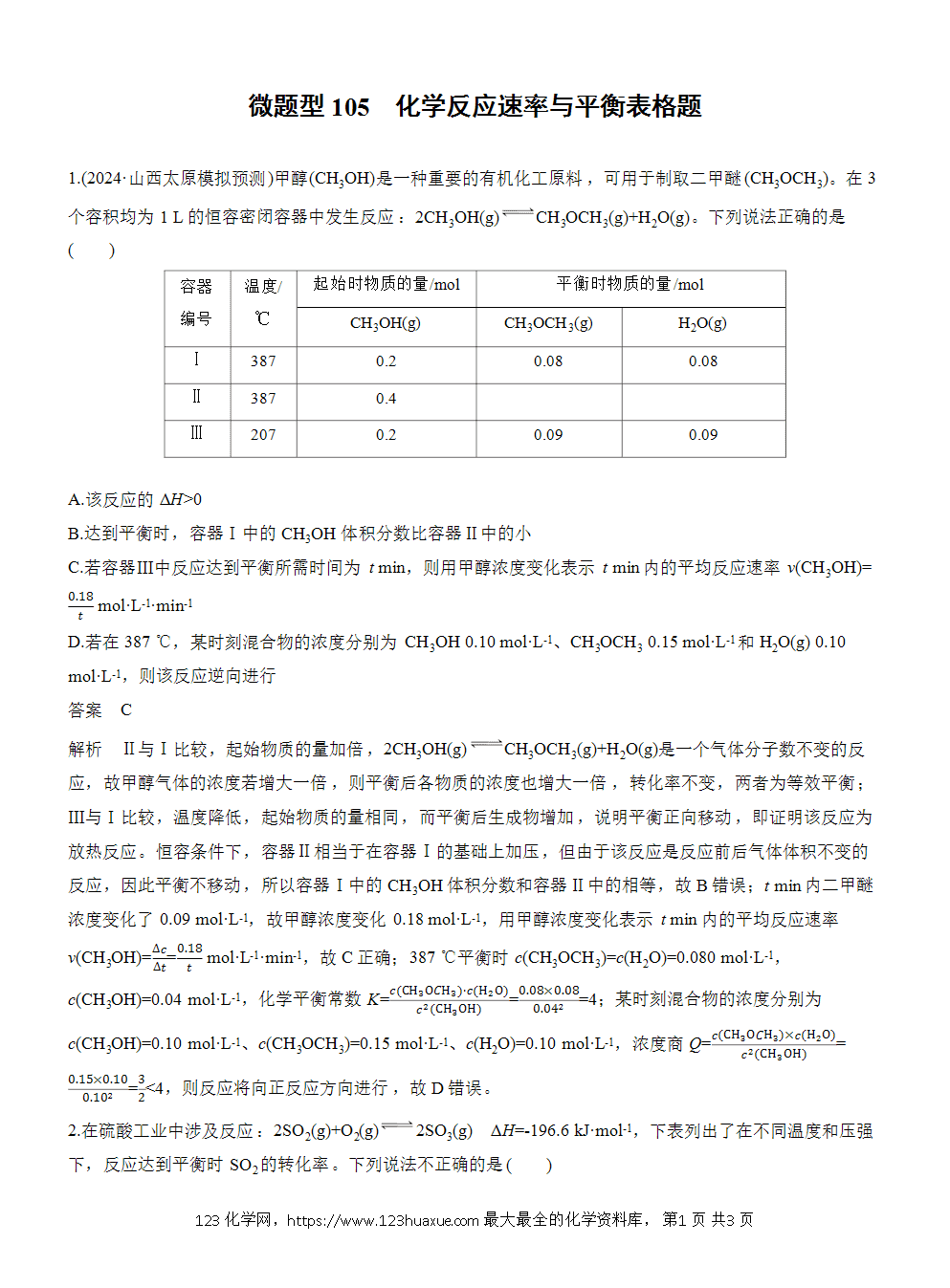
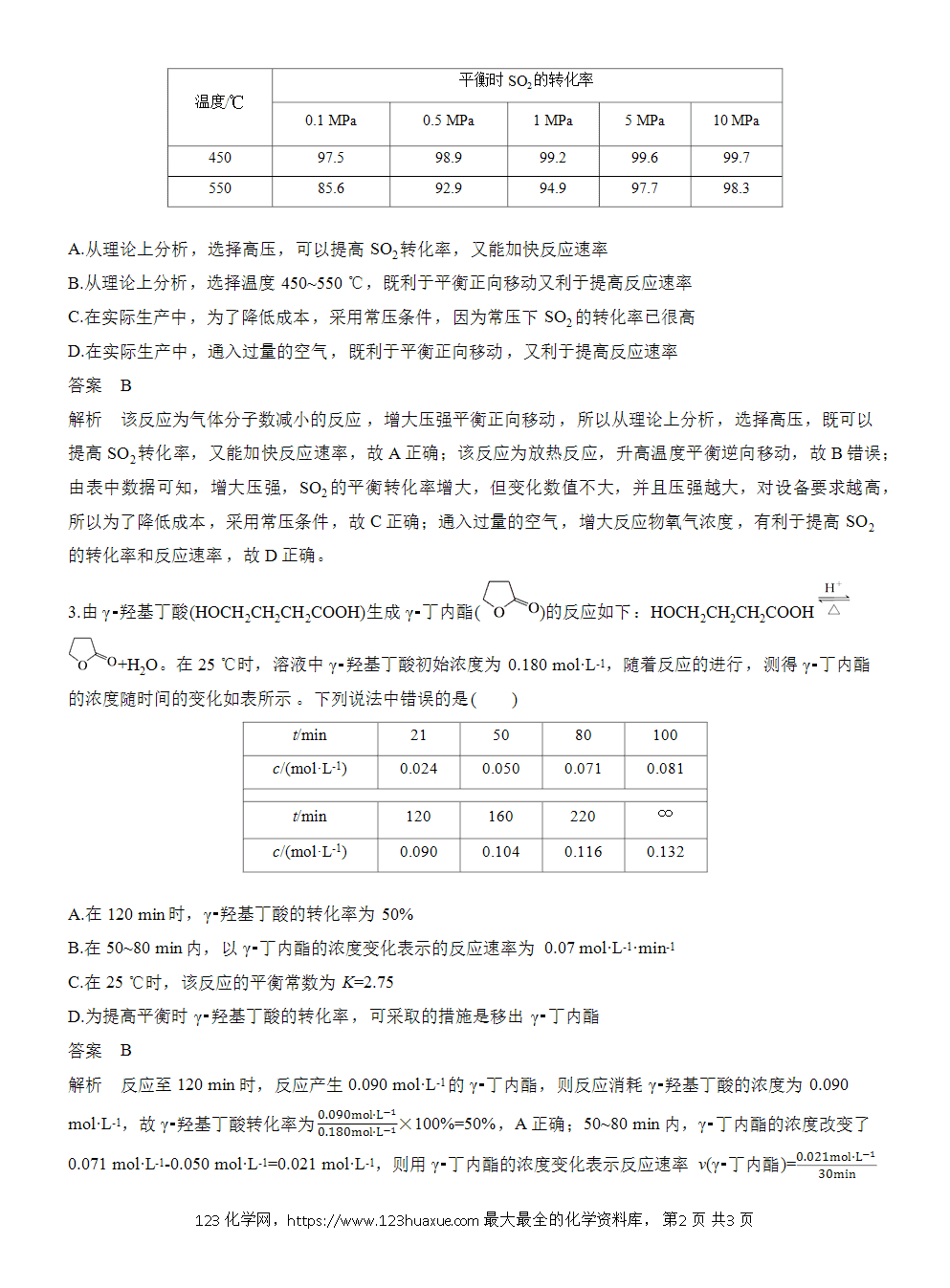

A.该反应的ΔH>0
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.若容器Ⅲ中反应达到平衡所需时间为t min,则用甲醇浓度变化表示t min内的平均反应速率v(CH3OH)= mol·L-1·min-1
D.若在387 ℃,某时刻混合物的浓度分别为CH3OH 0.10 mol·L-1、CH3OCH3 0.15 mol·L-1和H2O(g) 0.10 mol·L-1,则该反应逆向进行
答案 C
解析 Ⅱ与Ⅰ比较,起始物质的量加倍,2CH3OH(g)CH3OCH3(g)+H2O(g)是一个气体分子数不变的反应,故甲醇气体的浓度若增大一倍,则平衡后各物质的浓度也增大一倍,转化率不变,两者为等效平衡;Ⅲ与Ⅰ比较,温度降低,起始物质的量相同,而平衡后生成物增加,说明平衡正向移动,即证明该反应为放热反应。恒容条件下,容器Ⅱ相当于在容器Ⅰ的基础上加压,但由于该反应是反应前后气体体积不变的反应,因此平衡不移动,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,故B错误;t min内二甲醚浓度变化了0.09 mol·L-1,故甲醇浓度变化0.18 mol·L-1,用甲醇浓度变化表示t min内的平均反应速率v(CH3OH)== mol·L-1·min-1,故C正确;387 ℃平衡时c(CH3OCH3)=c(H2O)=0.080 mol·L-1,c(CH3OH)=0.04 mol·L-1,化学平衡常数K===4;某时刻混合物的浓度分别为c(CH3OH)=0.10 mol·L-1、c(CH3OCH3)=0.15 mol·L-1、c(H2O)=0.10 mol·L-1,浓度商