















卤素是典型的非金属元素,其元素的非金属性强弱顺序为:F>Cl>Br>I。卤素单质均是氧化剂,其氧化能力强弱顺序为:F2>Cl2>Br2>I2。卤离子均具有还原性,其还原性强弱顺序为:I->Br->Cl->F-。
卤素单质均能与氢化合,但反应条件不同,生成的气态氢化物稳定性亦不同。气态氢化物稳定性大小顺序为:HF>HCl>HBr>HI。
5、同周期从左到右,元素原子失电子能力逐渐减弱,得电子能力逐渐增强;元素金属性逐渐减弱,非金属性逐渐增强,即:
6、同主族元素的性质变化规律
7、①明确四个关系式a.电子层数=周期序数。b.质子数=原子序数。c.最外层电子数=主族序数。
d.主族元素的最高正价=最外层电子数。最低负价=-|8-最外层电子数|。
8、只含有极性共价键的物质一般是不同种非金属元素形成的共价化合物,如SiO2、HCl、CH4等。
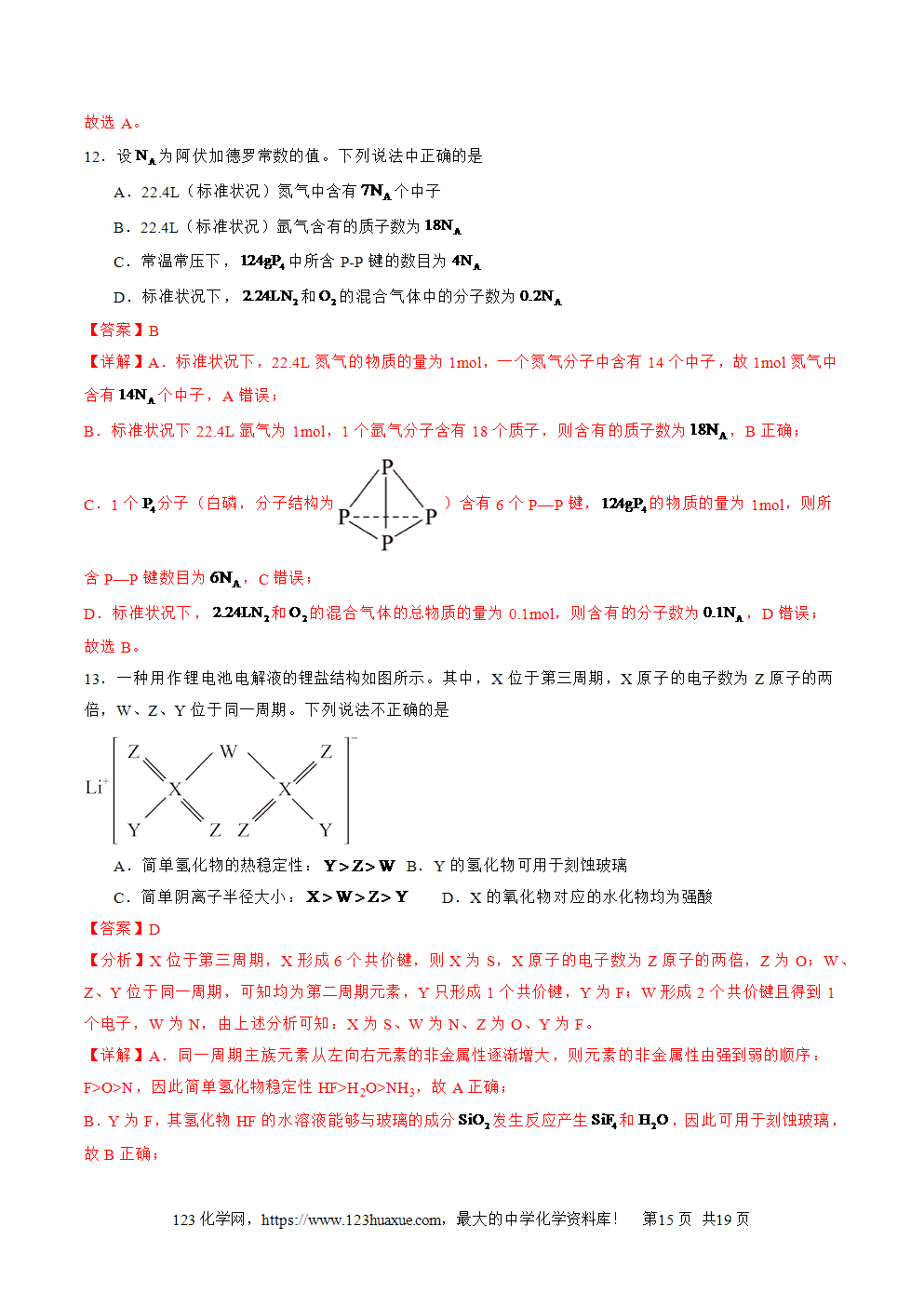
9、只含有非极性共价键的物质是同种非金属元素形成的单质,如Cl2、P4、金刚石等。
10、既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等。
11、只含离子键的物质主要是由活泼非金属元素与活泼金属元素形成的化合物,如Na2S、CaCl2、NaCl等。
12、既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
13、仅由非金属元素形成的离子化合物,如NH4Cl、NH4NO3等。
14、金属元素和非金属元素间可能存在共价键,如AlCl3等。
15、存在氢键的物质,其熔、沸点明显高于同族同类物质,如H2O的熔、沸点高于H2S。若分子间形成氢键,会使物质的熔点和沸点升高。分子内氢键使物质的熔沸点降低。
16、氨极易液化,是因为NH3分子间存在氢键;NH3极易溶于水,也是因为NH3分子与H2O分子间易形成氢键。
17、水结冰时体积膨胀、密度减小,是因为结冰时形成了氢键,DNA的结构等都与氢键有关。