






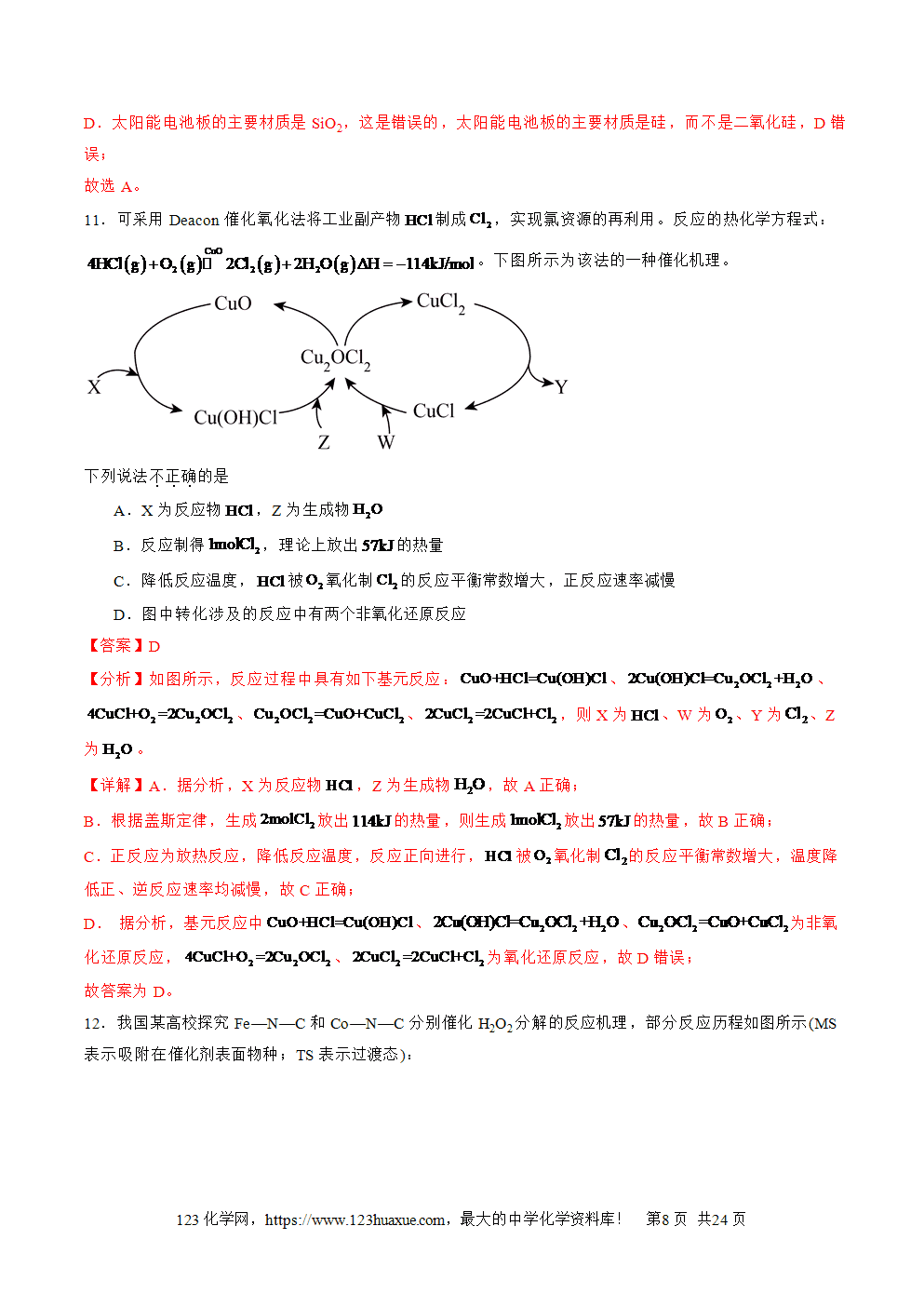
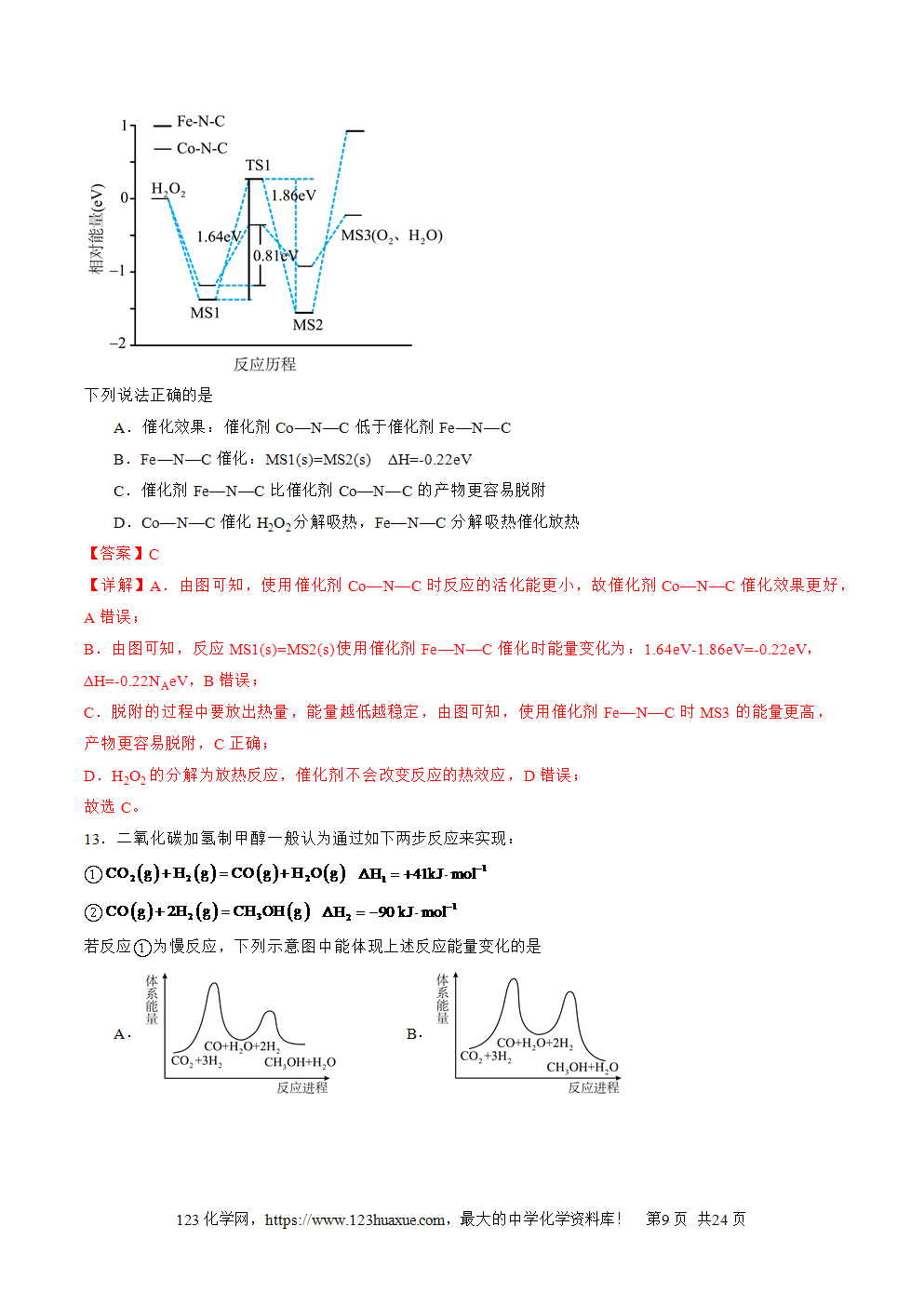



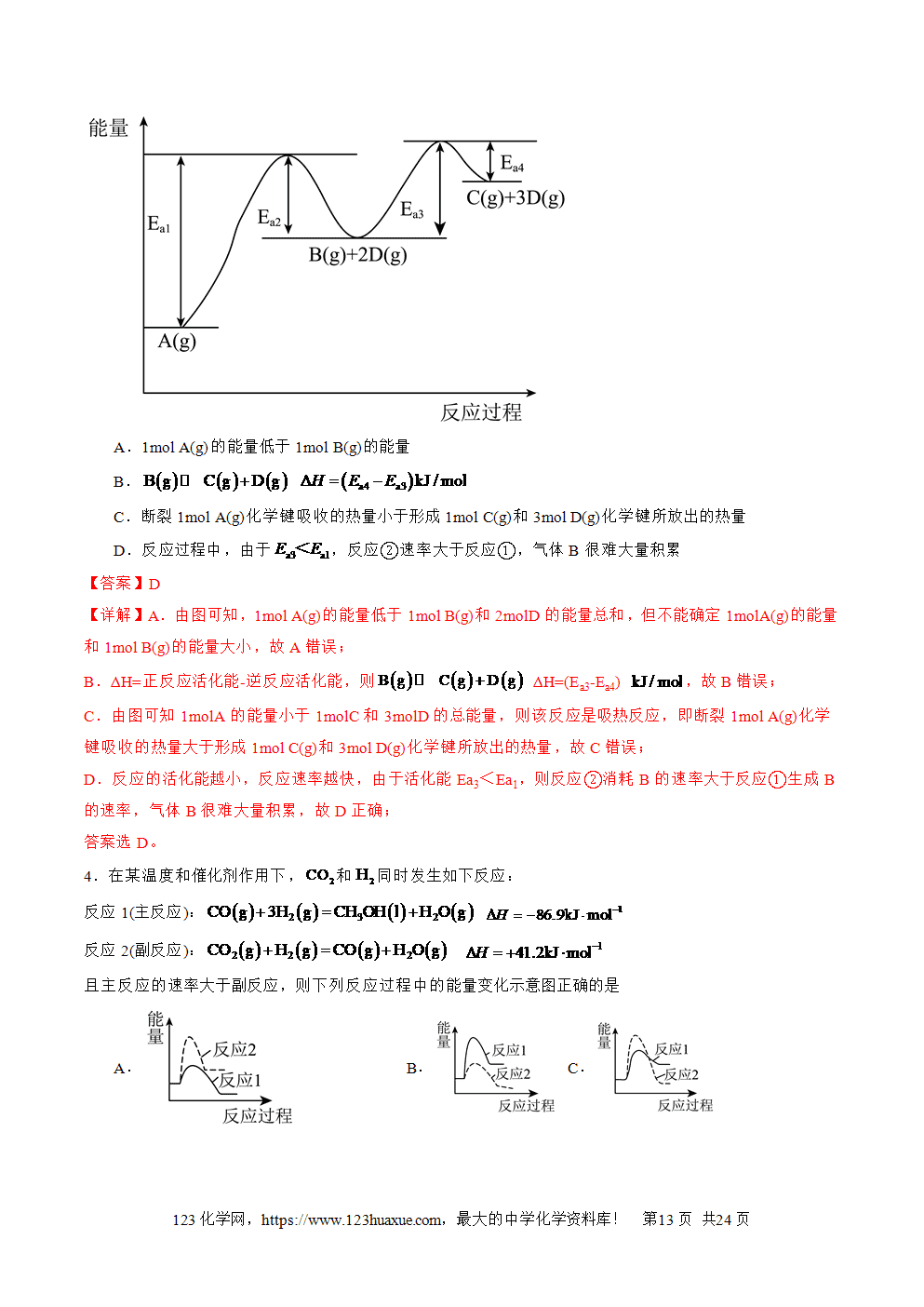
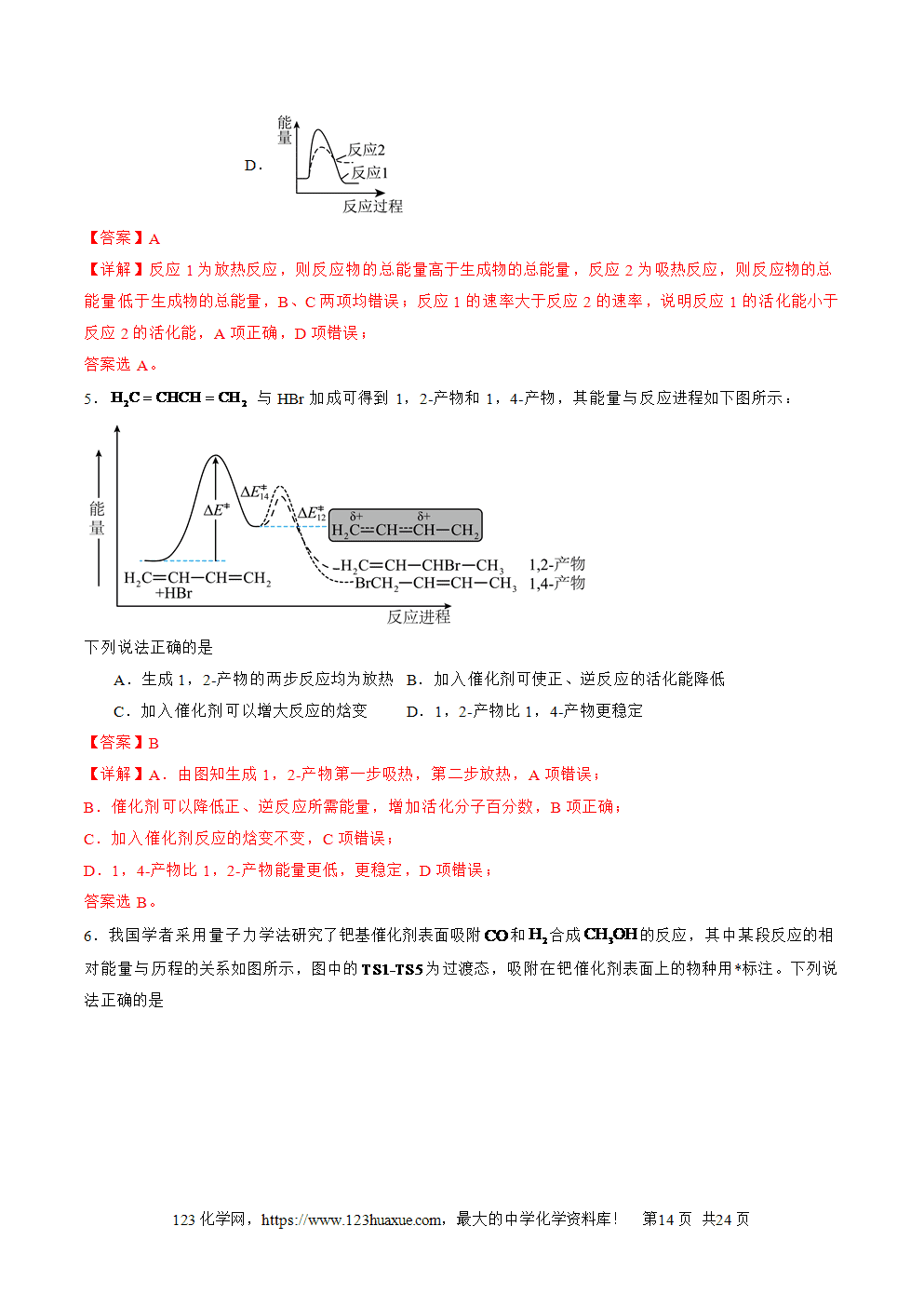

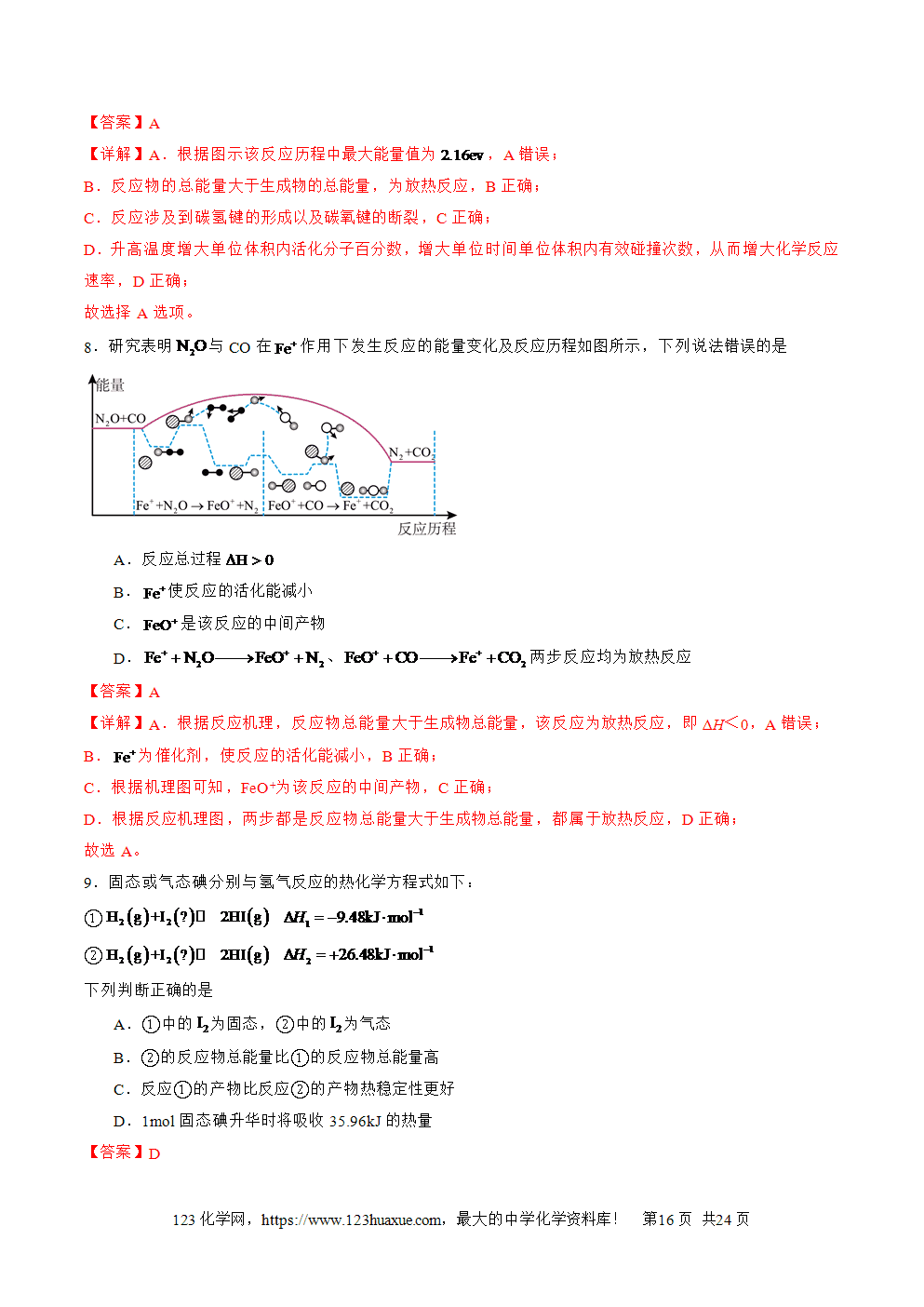

1.放热反应:释放热量的化学反应。吸热反应:吸收热量的化学反应。
2.吸热反应、放热反应的判定E1>E2,新化学键的形成所释放的能量小于破坏旧化学键所吸收的能量,该反应就是吸热反应;E1<E2,新化学键的形成所释放的能量大于破坏旧化学键所吸收的能量,该反应就是放热反应。
①物质本身所具有的能量越低,说明其结构越稳定,热稳定性强,断裂其化学键所吸收的能量就越高,而形成其化学键所释放的能量也越多。②反应的条件与反应的热效应没有必然的联系,每一个反应都有特定的条件,需要点燃或加热的反应不一定是吸热反应。例如燃烧都是放热反应,但是反应要达到着火点。
3.常见的放热反应:
①所有的燃烧反应;②大多数的化合反应(注:CO2+C2CO为吸热反应);③酸碱中和反应;
④金属与酸或水的反应;⑤缓慢的氧化反应;
4.常见的吸热反应:①大多数的分解反应;②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2与NH4Cl反应:Ba(OH)2·8H2O+2NH4Cl==2NH3↑+BaCl2+10H2O;③以C、H2、CO为还原剂的氧化还原反应,如CO2+C2CO;C+H2O(g)CO+H2;3Fe+4H2O(g)Fe3O4+4H2
④需要持续加热的反应
5.化学反应实质:化学反应的过程就是反应物分子中的原子重新组合成生成物分子的过程,也就是反应物分子中化学键断裂和生成物分子中化学键形成的过程。
6.化学反应特征:①物质变化:有新物质生成,遵循质量守恒定律;②能量变化:释放或吸收能量,遵循能量守恒定律。
7.化学反应中能量变化的原因(1)断开化学键吸收能量例:1molH2中含有1molH—H键,常温常压下断开1molH—H键,需要吸收436kJ的热量。
(2)形成化学键放出能量由2molH原子生成1molH2,有1molH—H键生成,生成过程中向外界释放436kJ的热量。
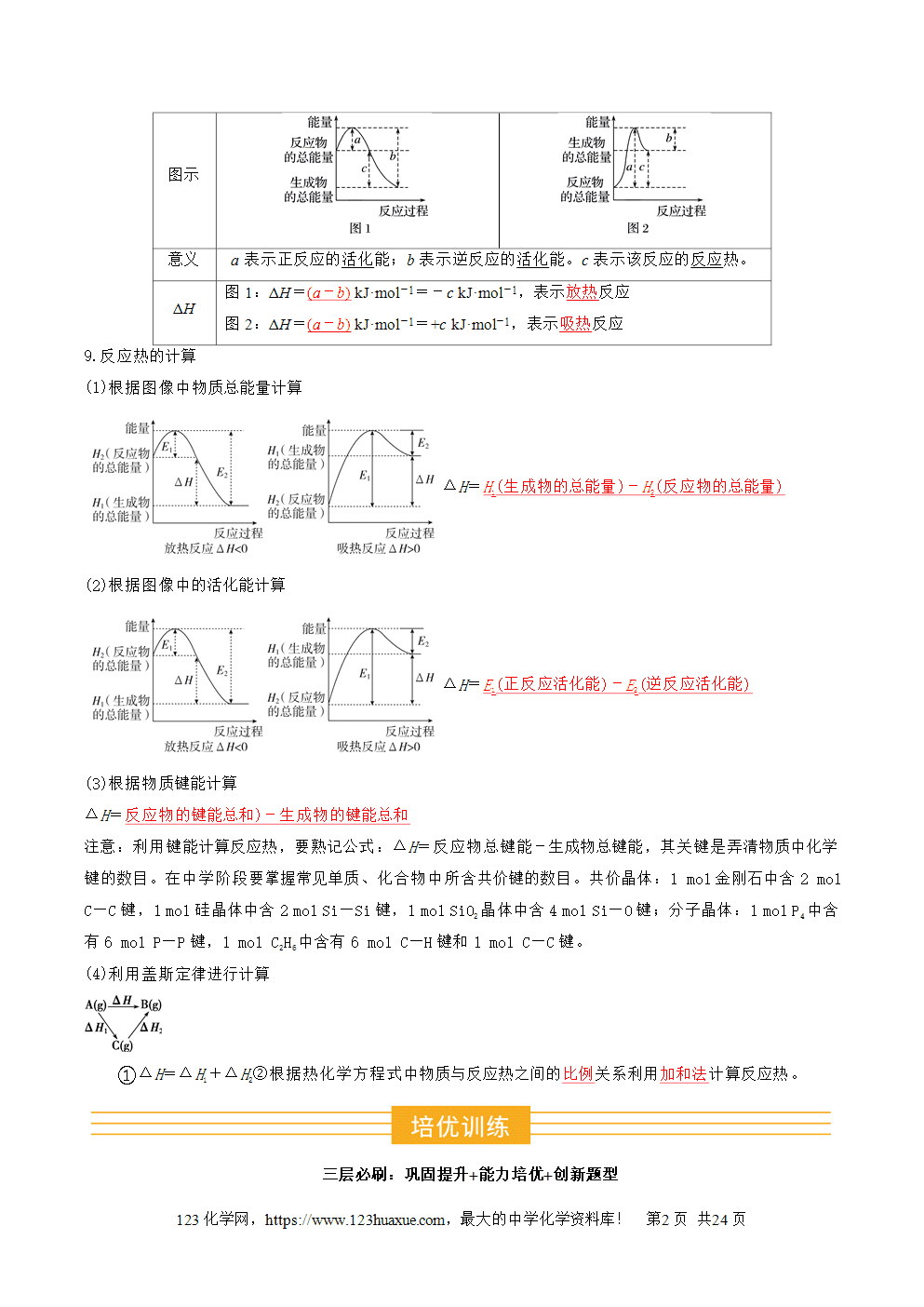
8.理解反应历程与反应热的关系