

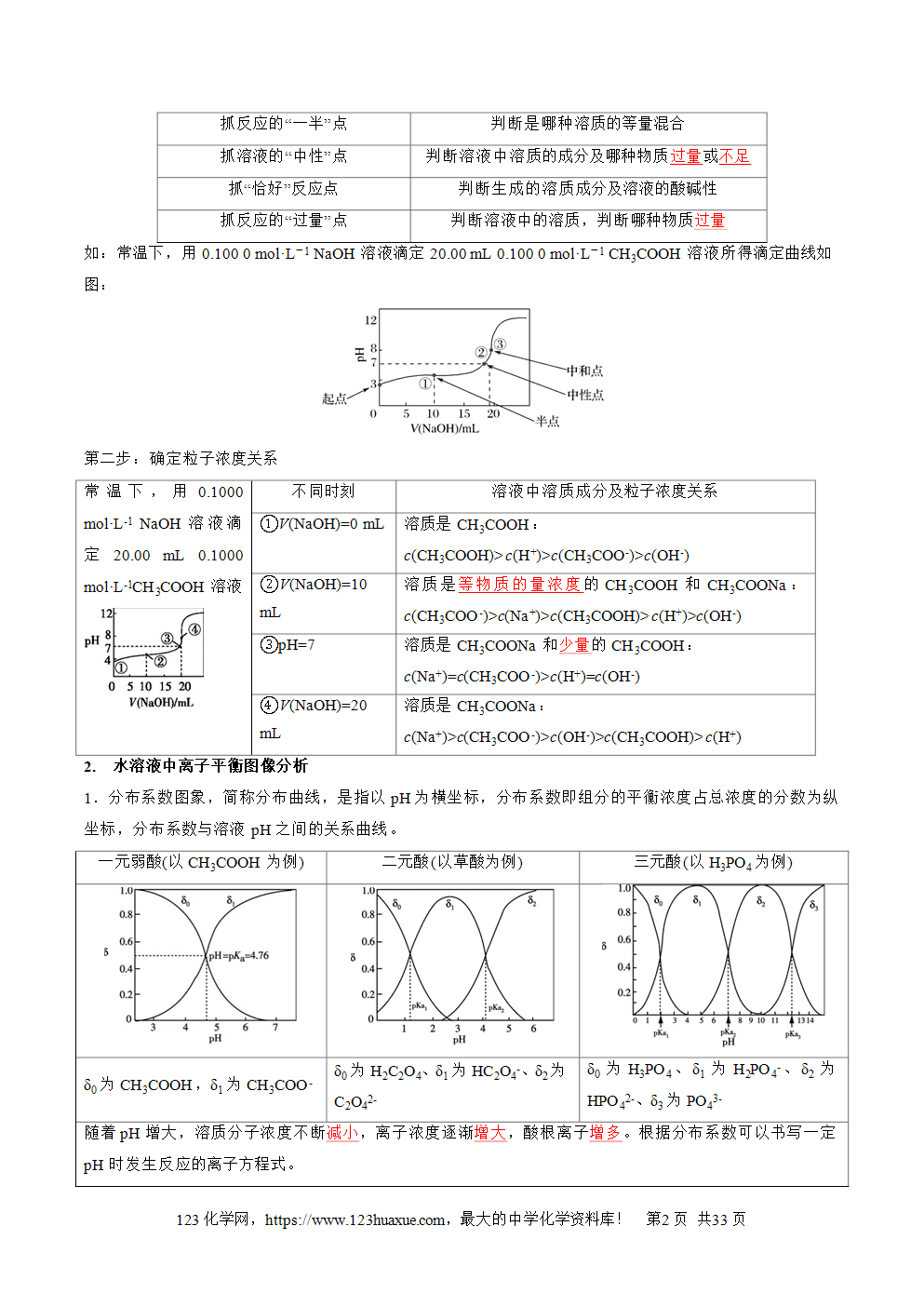

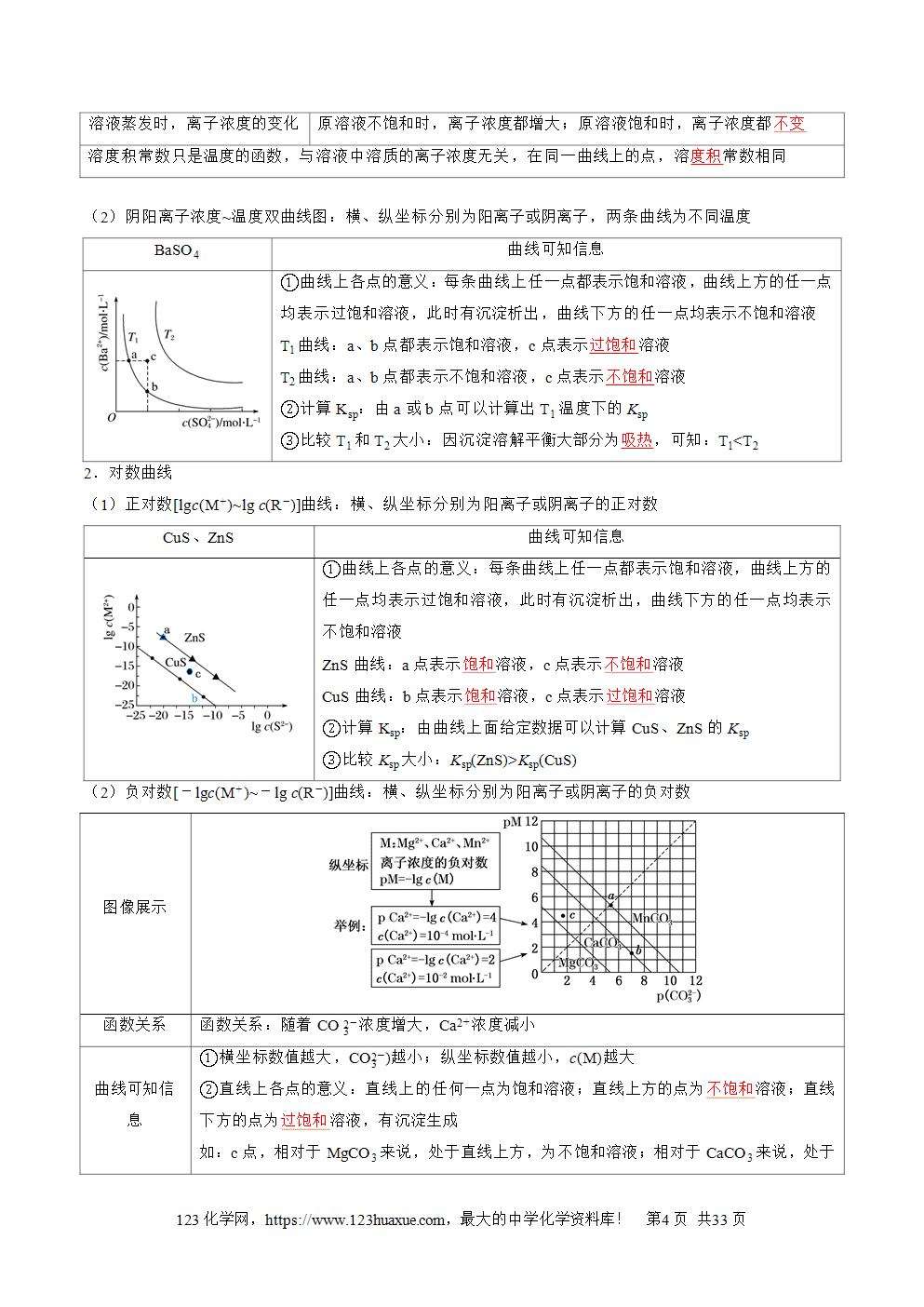



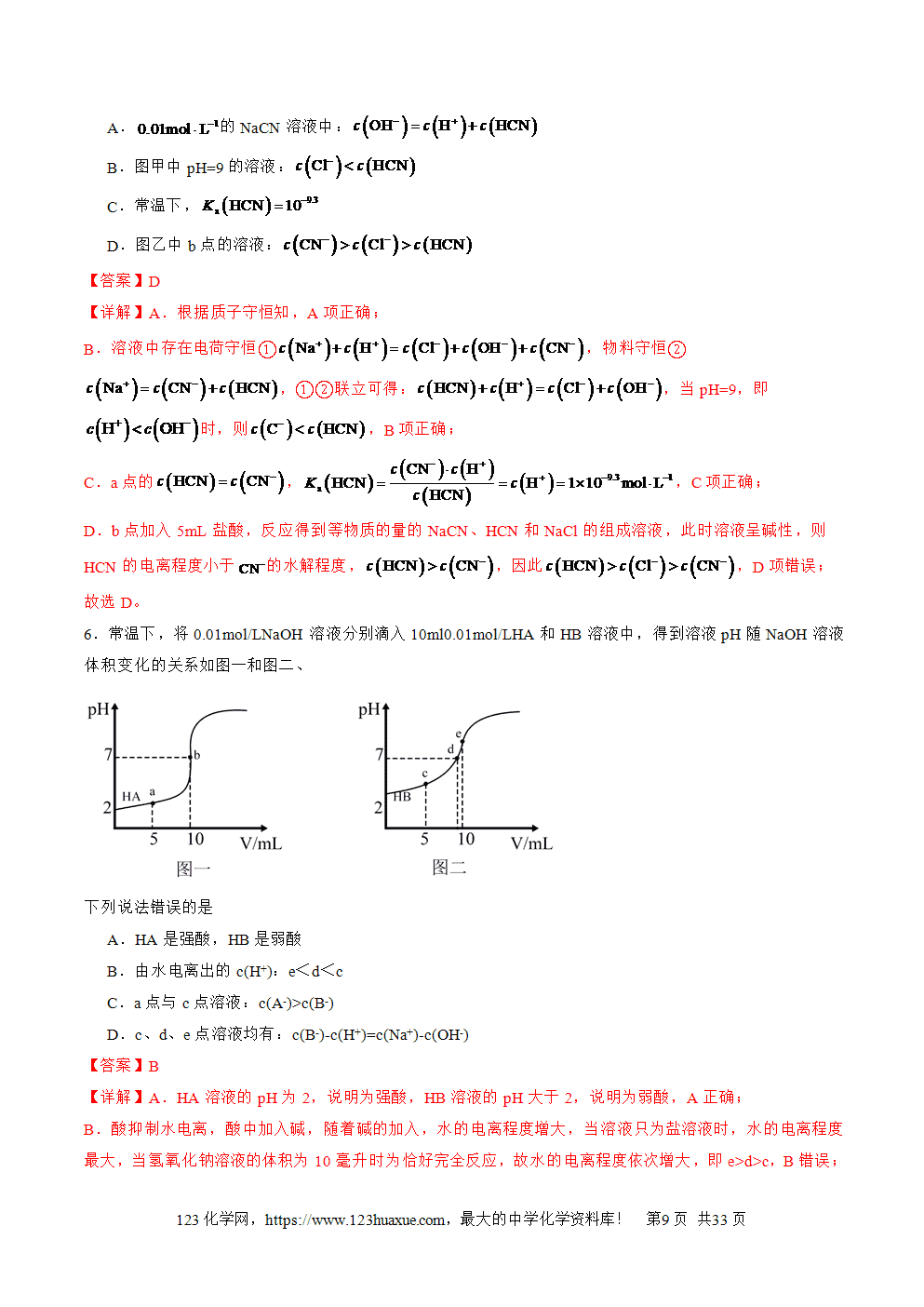



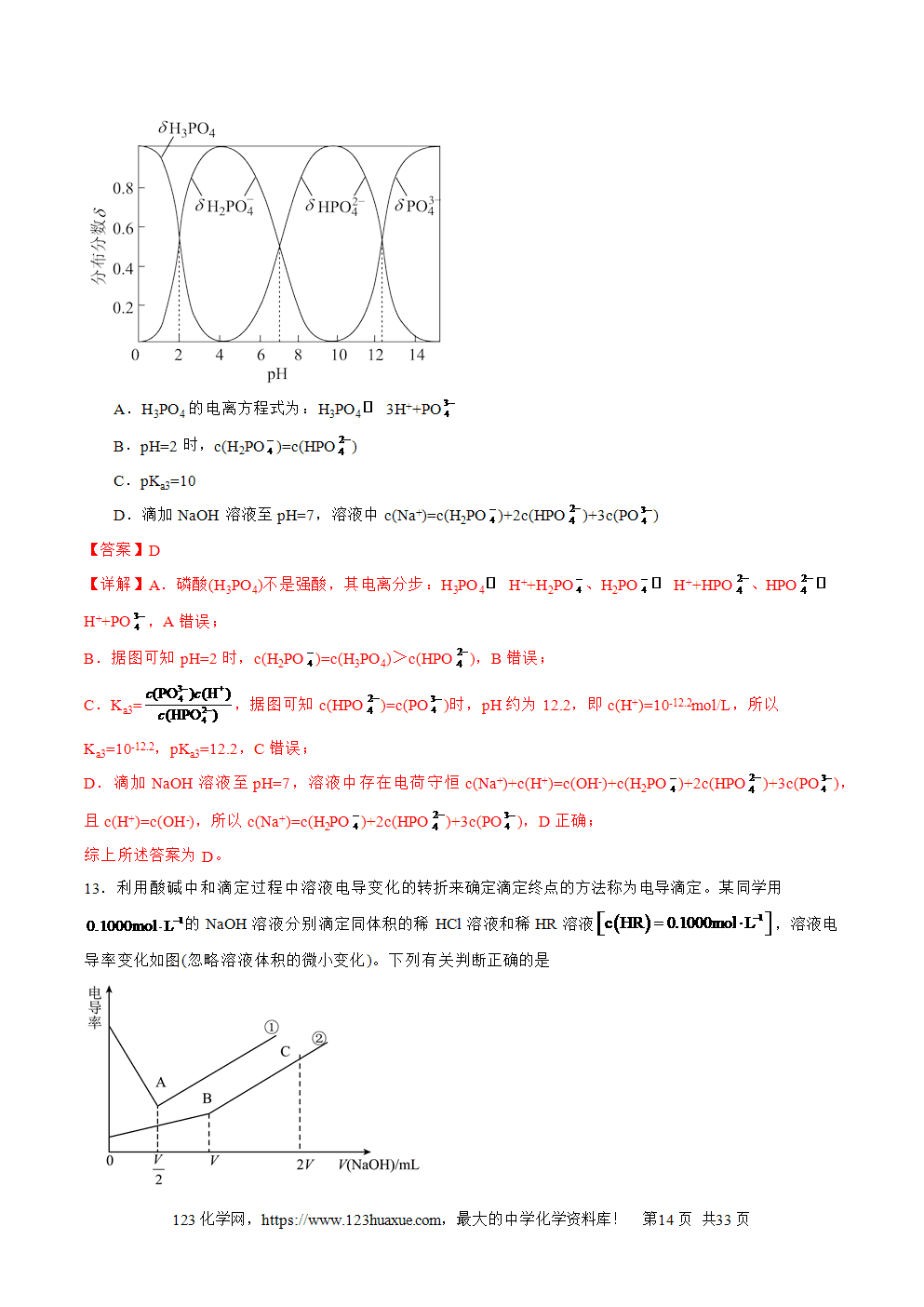

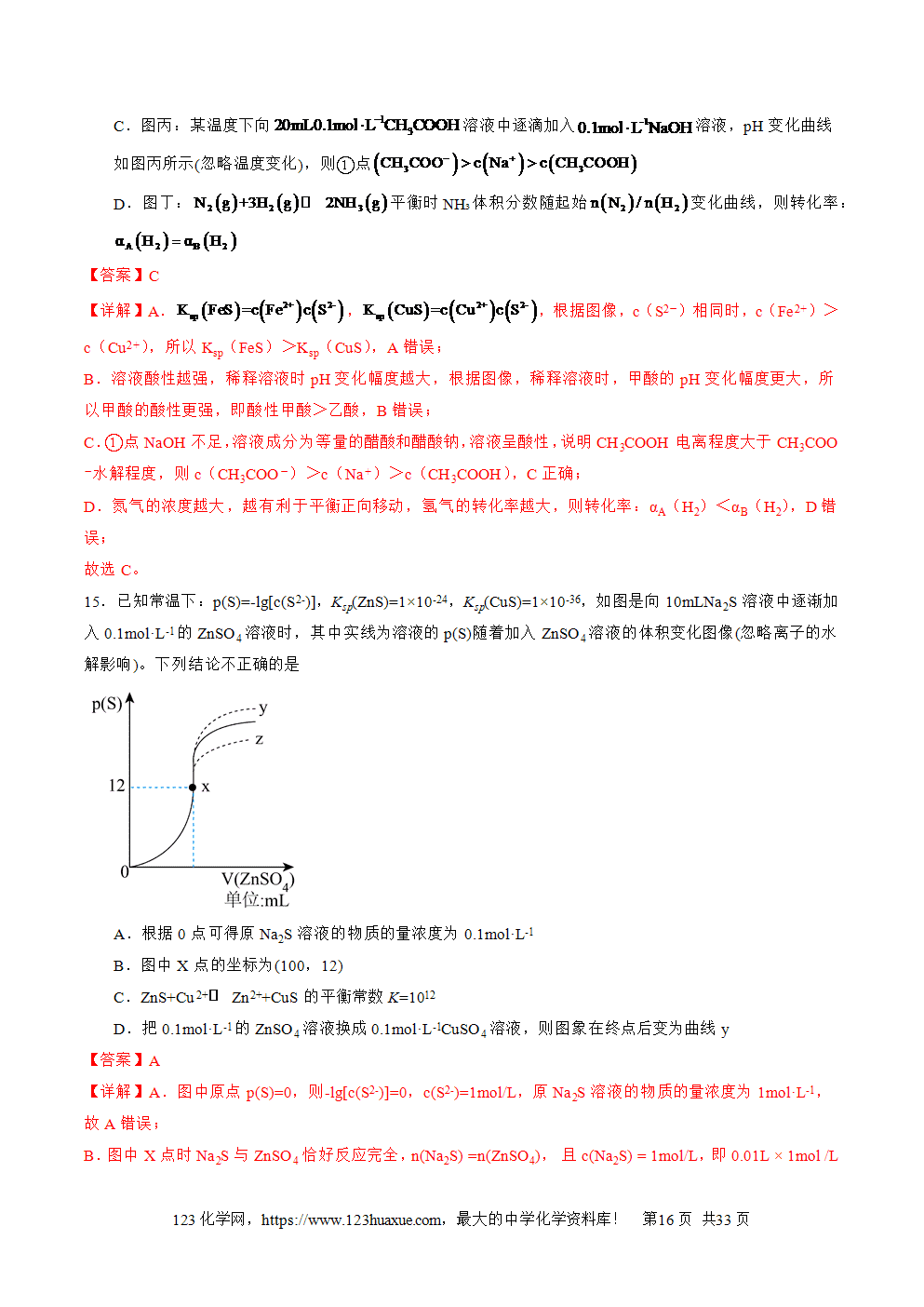
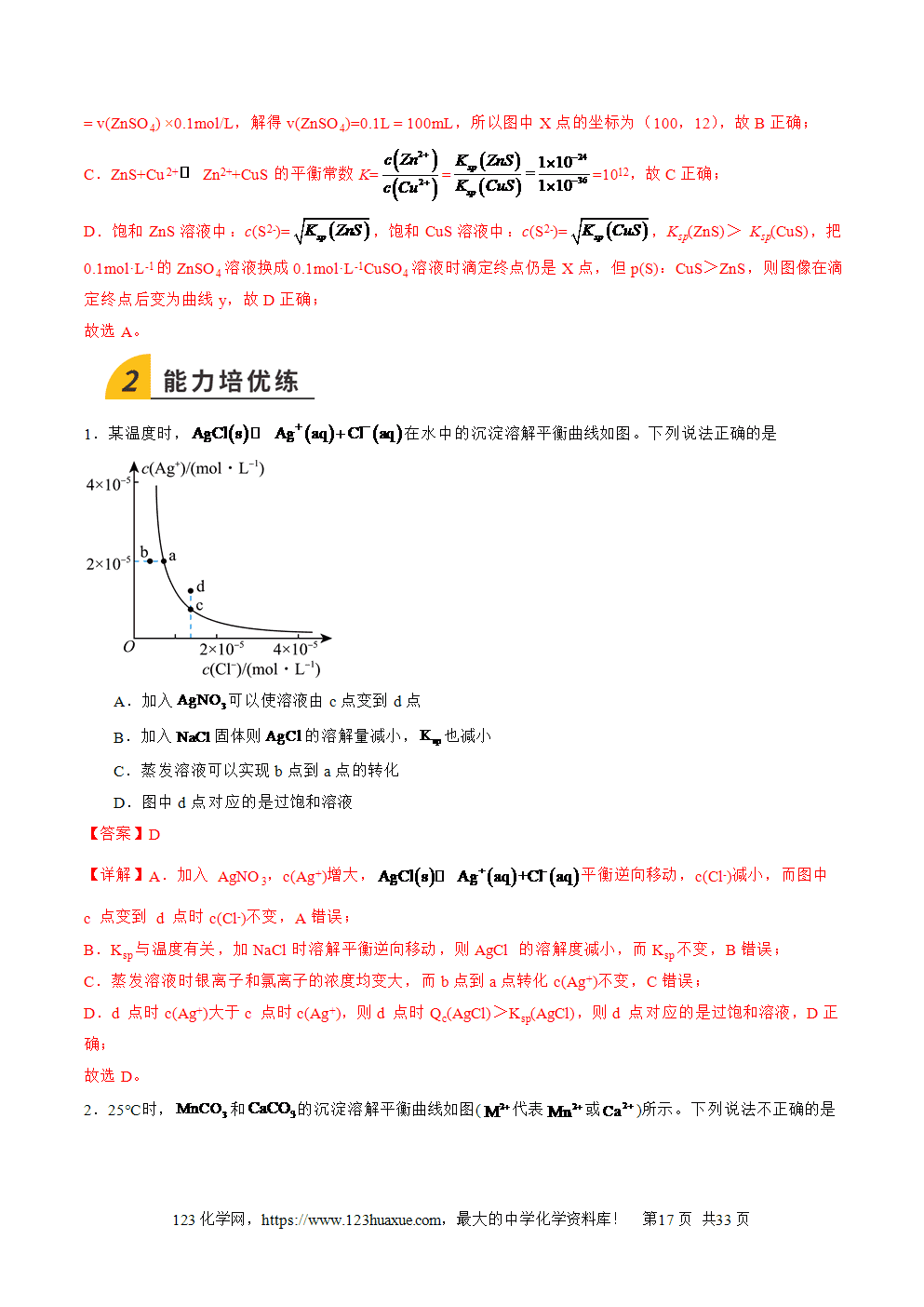

三层必刷:巩固提升+能力培优+创新题型
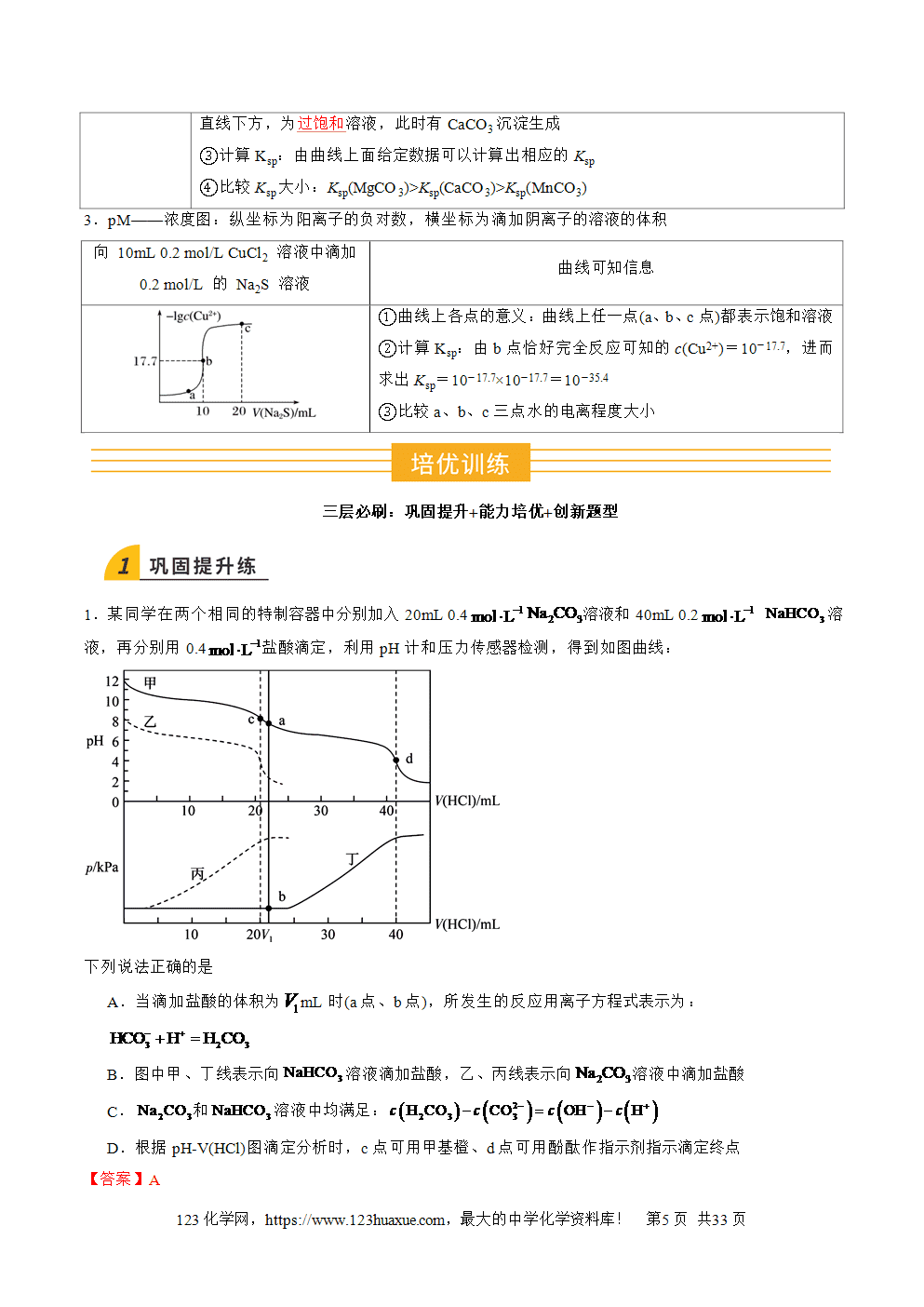
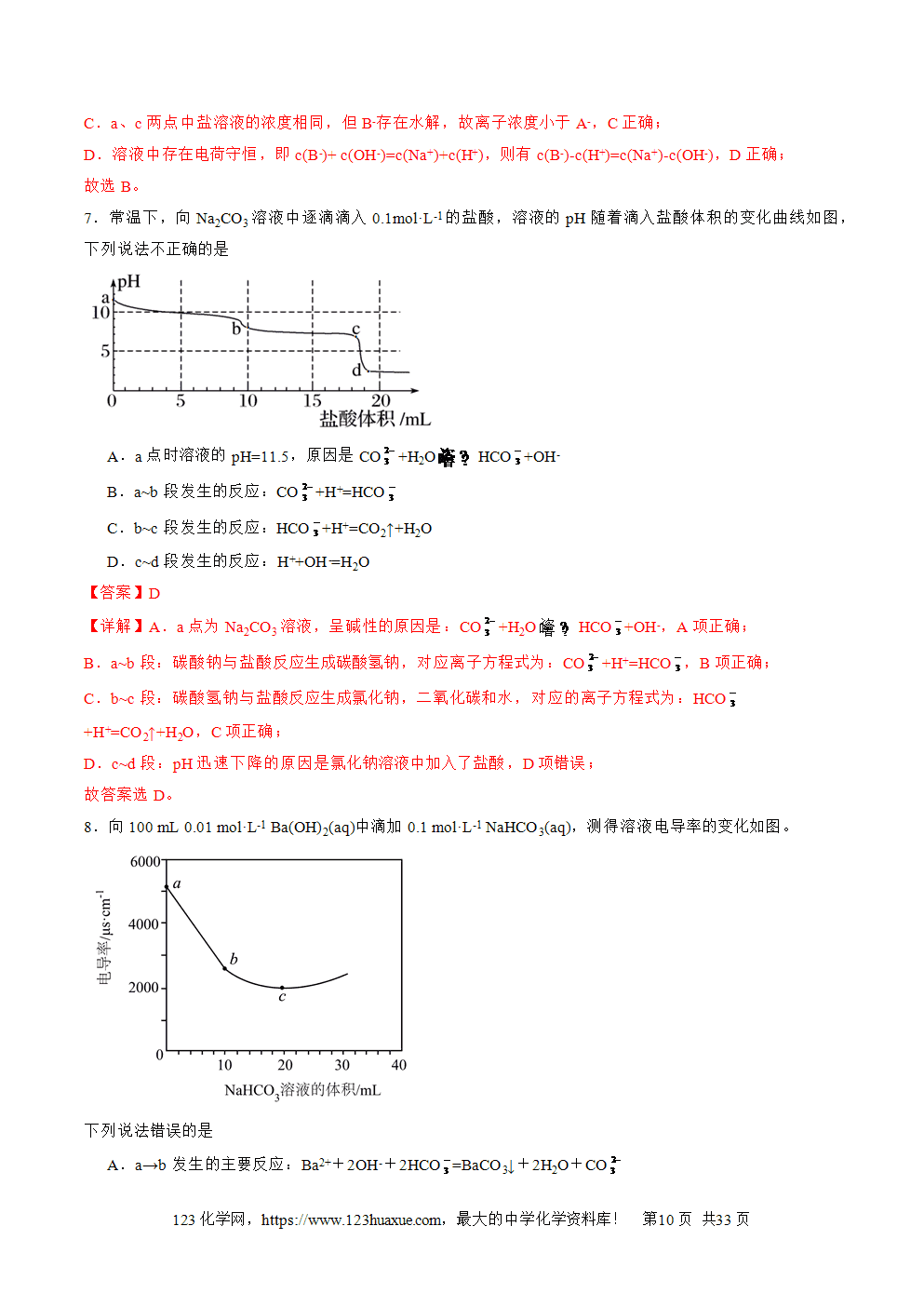
1.某同学在两个相同的特制容器中分别加入20mL 0.4溶液和40mL 0.2 溶液,再分别用0.4盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:
下列说法正确的是
A.当滴加盐酸的体积为mL时(a点、b点),所发生的反应用离子方程式表示为:
B.图中甲、丁线表示向溶液滴加盐酸,乙、丙线表示向溶液中滴加盐酸
C.和溶液中均满足:
D.根据pH-V(HCl)图滴定分析时,c点可用甲基橙、d点可用酚酞作指示剂指示滴定终点
【答案】A
【分析】的水解程度大于,则0.4mol•L-1溶液的碱性强于40mL0.2mol•L-1溶液,与HCl反应先生成,再与盐酸反应生成CO2气体,直接与HCl反应生成CO2气体,并且n()=n()=0.008mol,分别加入20mL0.4mol•L-1HCl时恰好转化为,容器中压强不变,随着HCl的加入,容器中压强逐渐增大,加入40mLHCl时容器的压强达到最大值,直接与HCl反应生成CO2气体,容器中压强增大,并且加入20mLHCl时容器的压强达到最大值、一直保持不变,所以图中甲、丁线表示向溶液中滴加盐酸,乙、丙线表示向溶液中滴加盐酸;
【详解】A.由分析,当滴加盐酸的体积为mL时,盐酸体积大于20mL,则(a点、b点)所发生的反应为碳酸氢根离子和氢离子生成碳酸,A正确;
B.由分析,图中甲、丁线表示向溶液中滴加盐酸,乙、丙线表示向溶液中滴加盐酸,B错误;
C.Na2CO3溶液中存在质子守恒:;NaHCO3溶液中存在质子守恒:,C错误;
D.由图可知,滴定分析时,c点的pH在9左右,在酚酞的变色范围内,可选择酚酞作指示剂;d点的pH在4左右,在甲基橙的变色范围内,可选择甲基橙作指示剂,D错误;
故选A。