

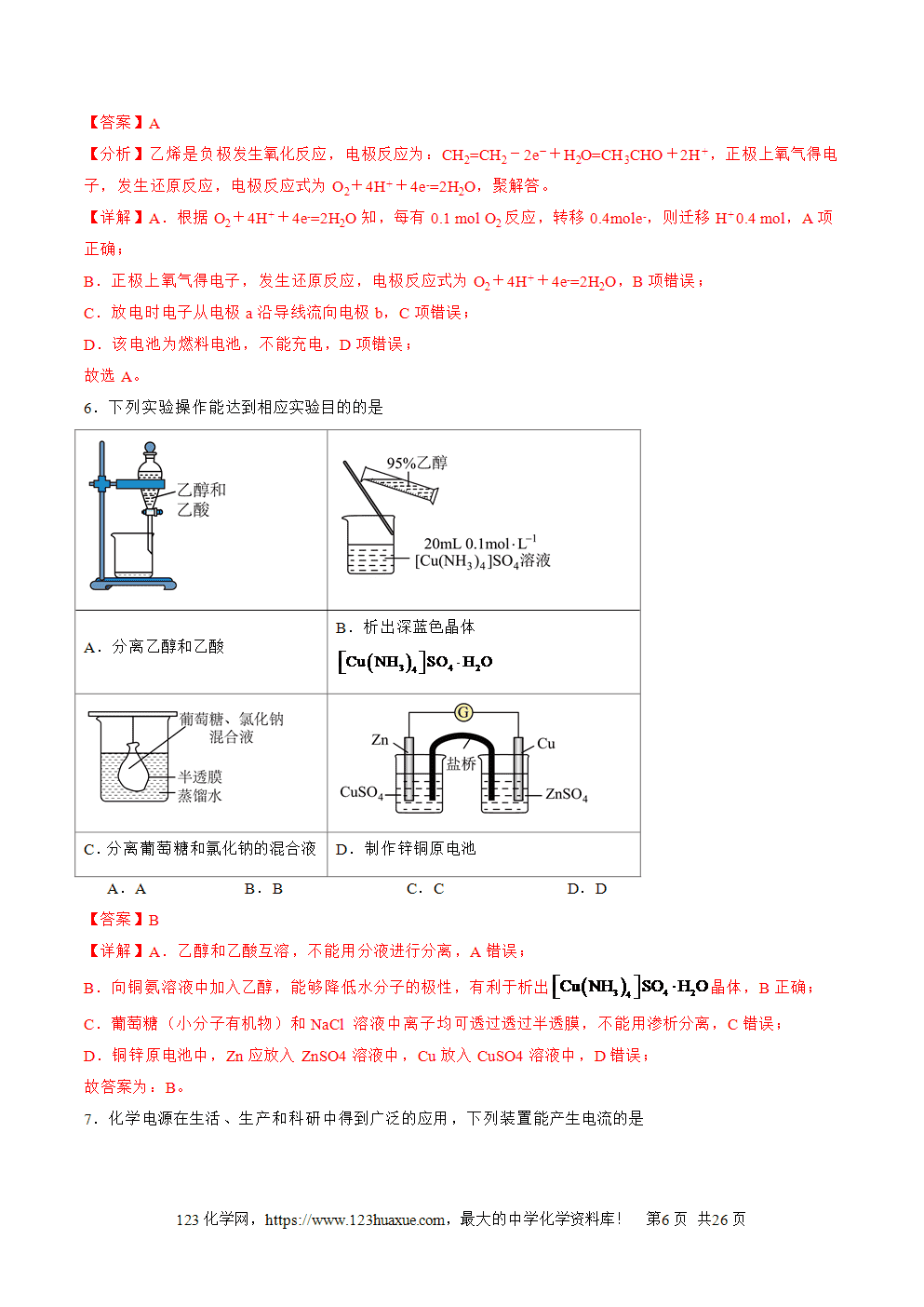
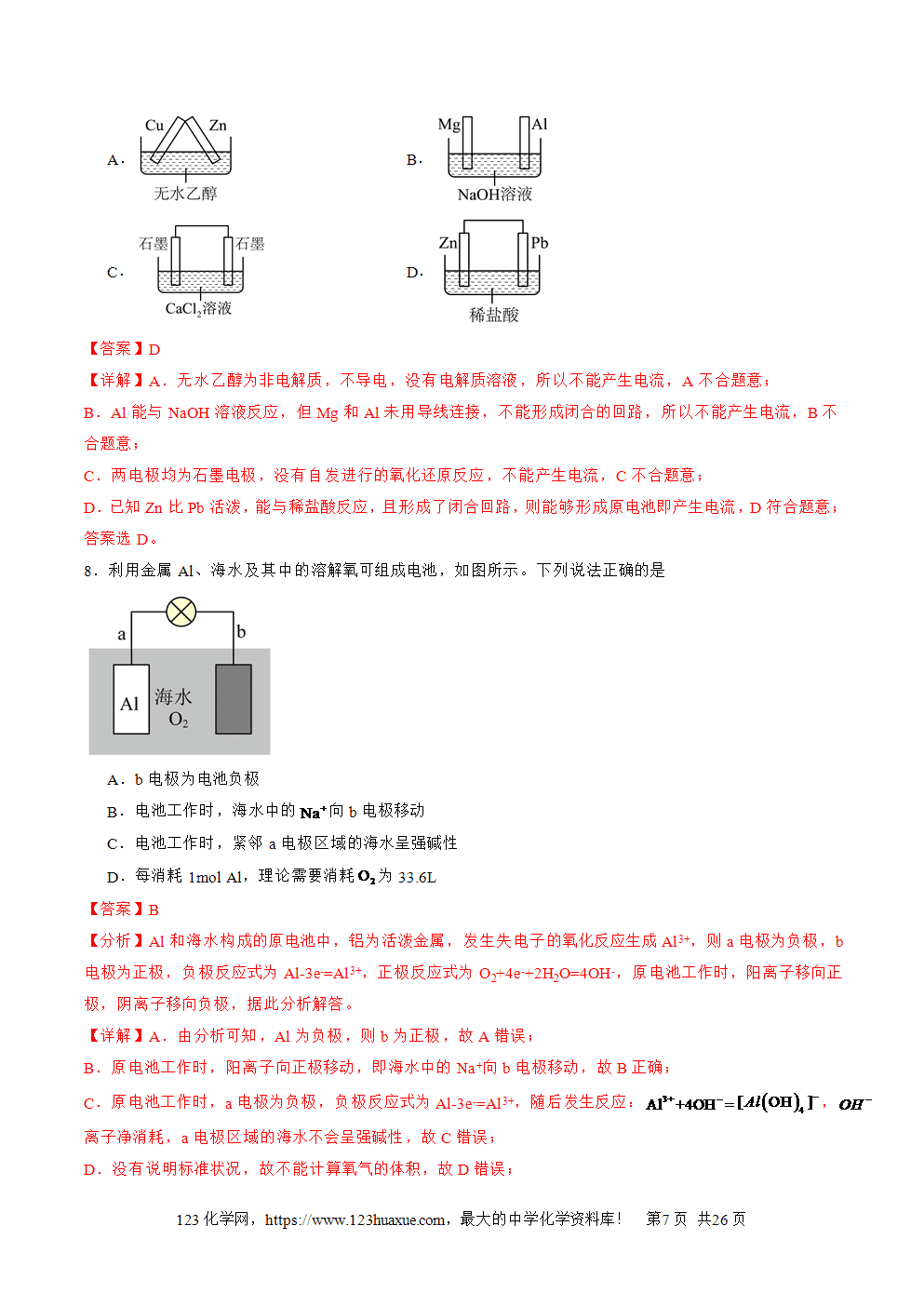



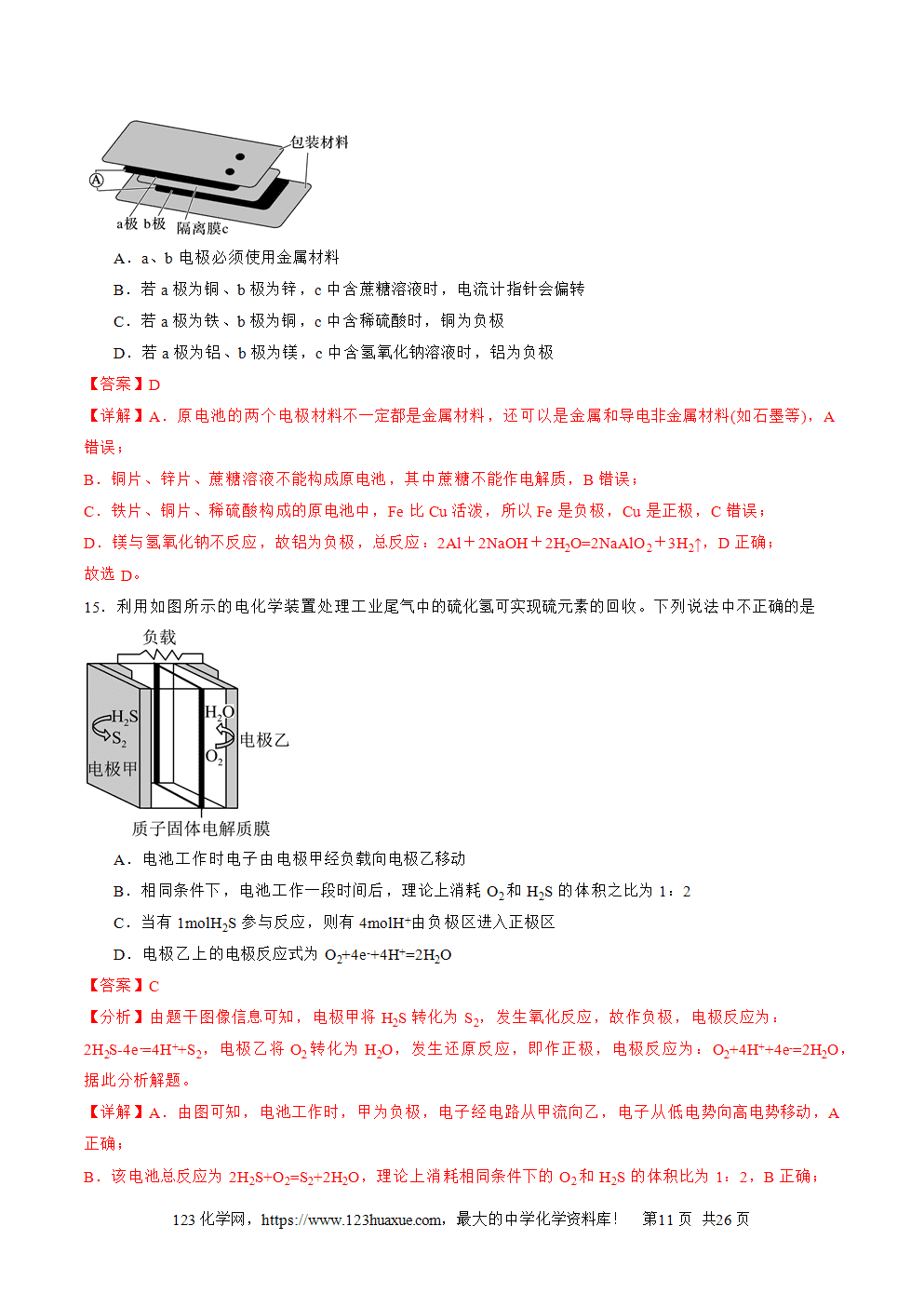
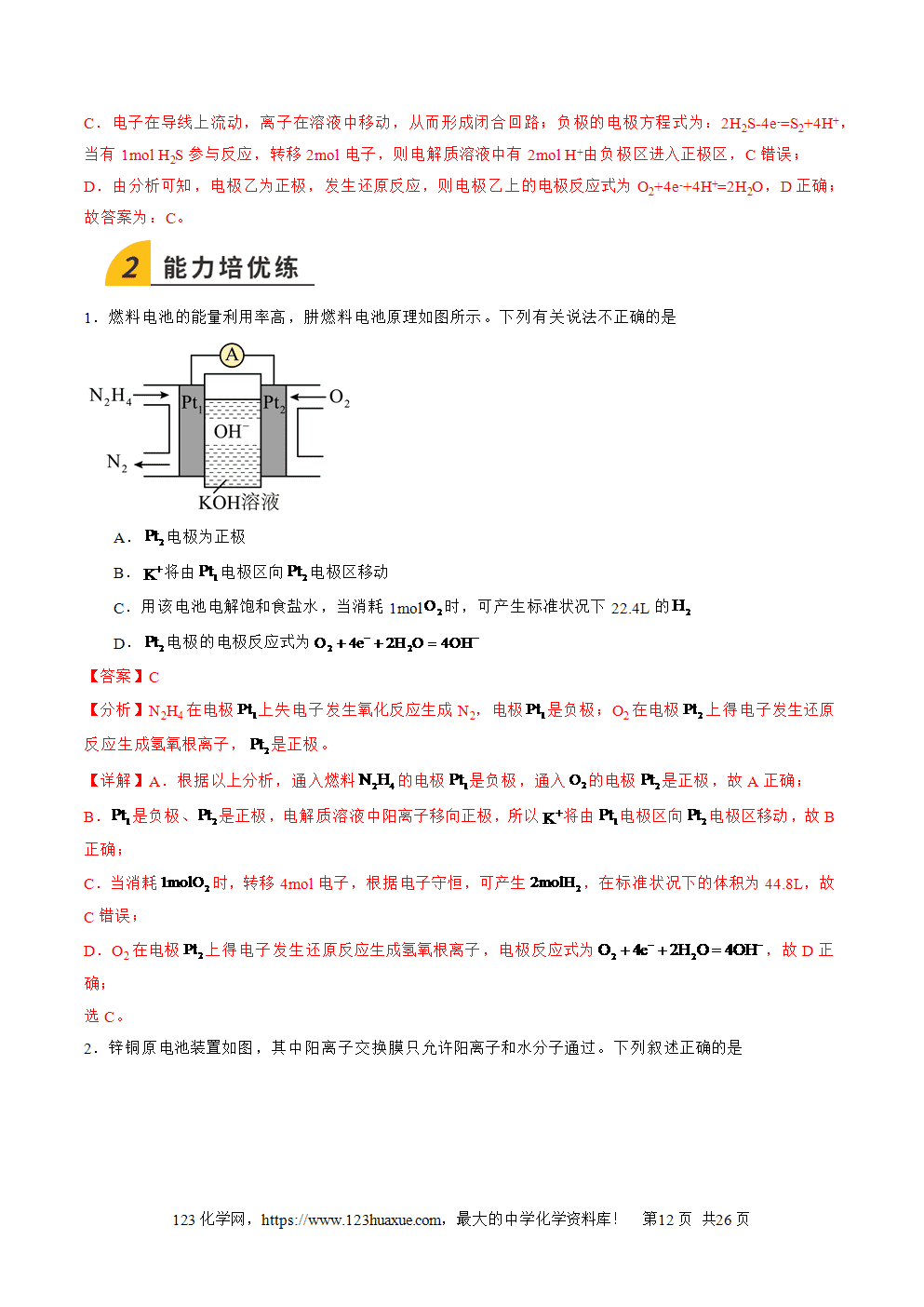





1.原电池的概念和反应本质:原电池是把化学能转化为电能的装置,其反应本质是自发进行的氧化还原反应。
2.构成条件
(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(2)二看两电极:一般是活泼性不同的两电极,较活泼的做负极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:
①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。
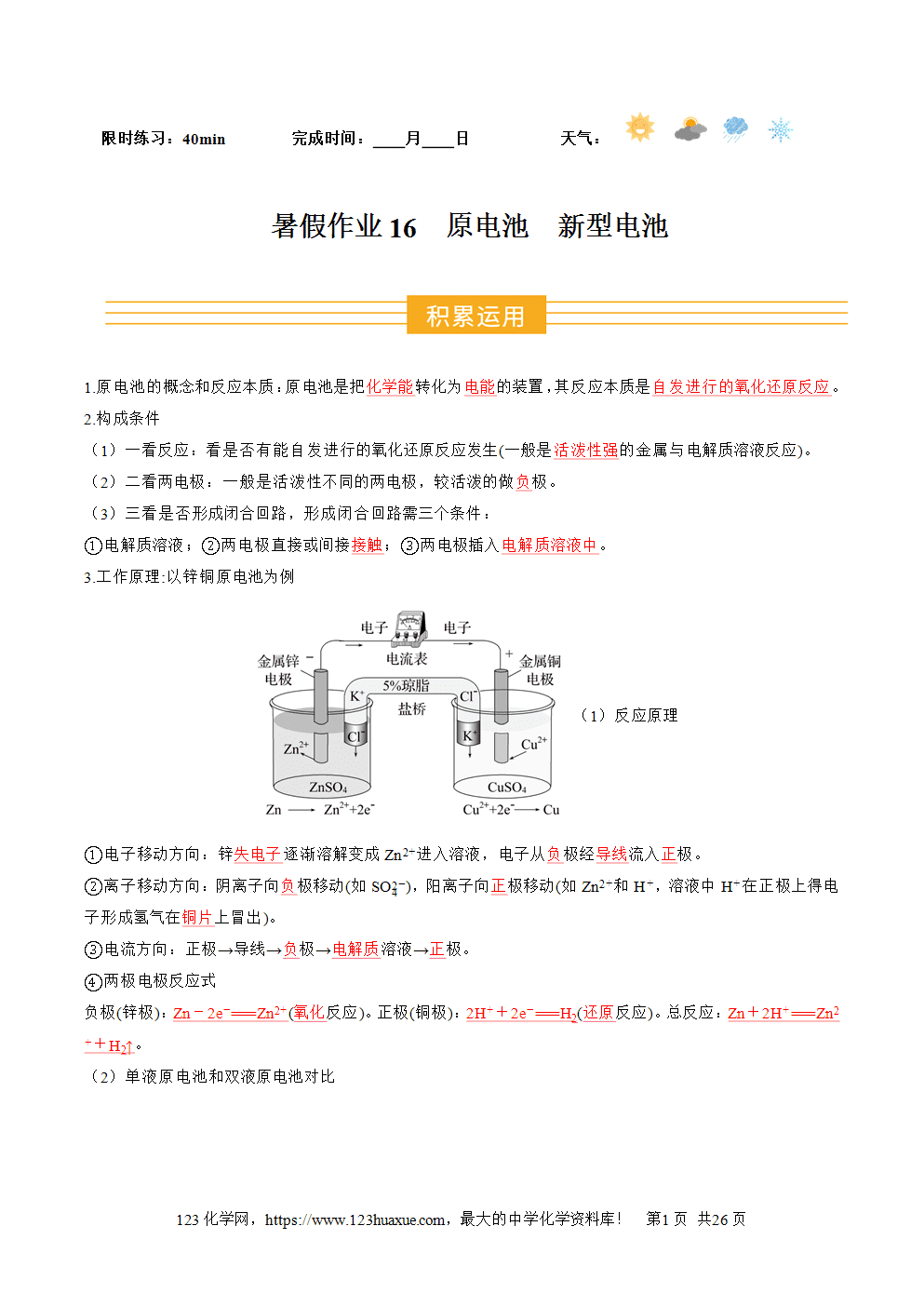
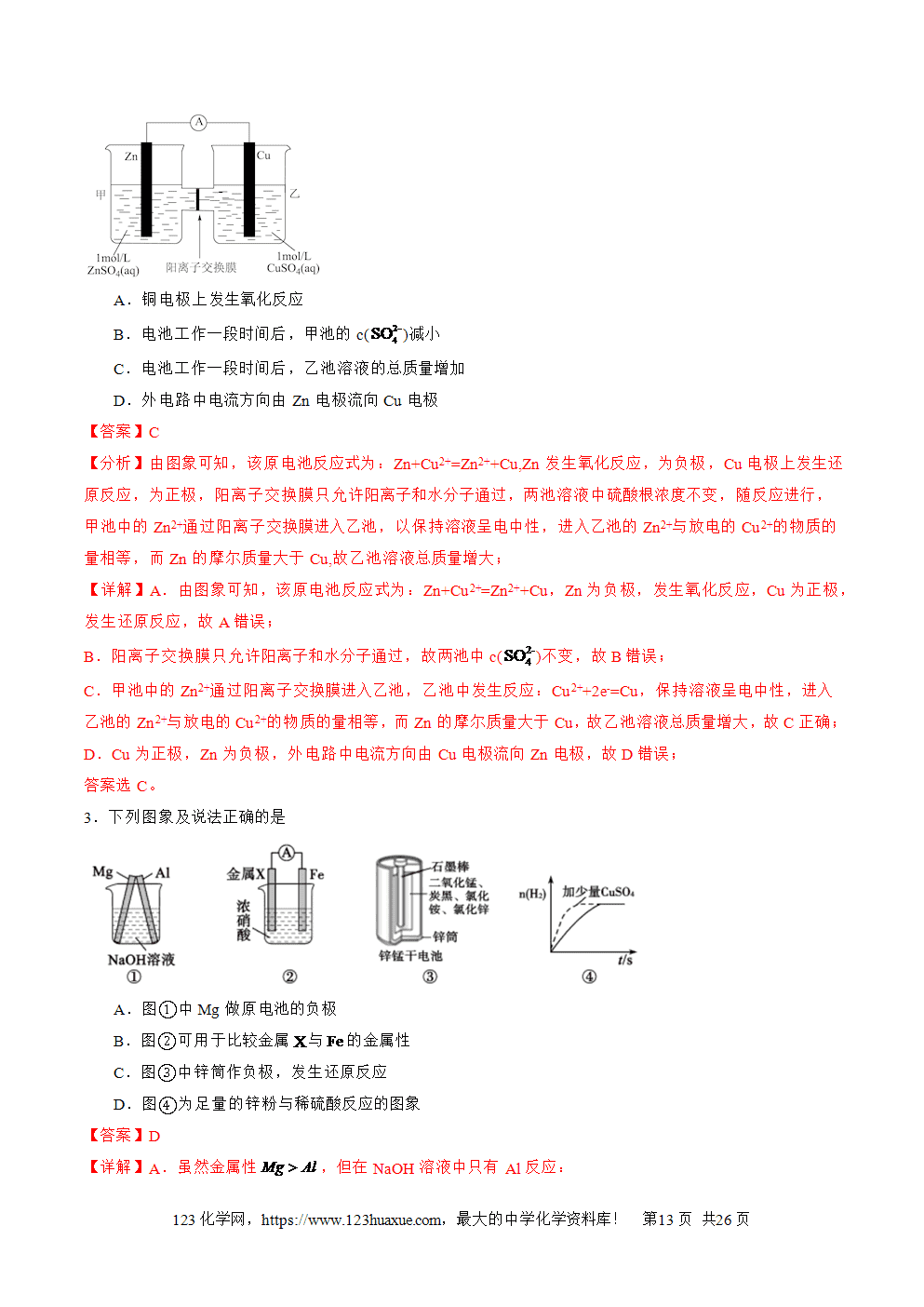
3.工作原理:以锌铜原电池为例
(1)反应原理
①电子移动方向:锌失电子逐渐溶解变成Zn2+进入溶液,电子从负极经导线流入正极。
②离子移动方向:阴离子向负极移动(如SO4(2-)),阳离子向正极移动(如Zn2+和H+,溶液中H+在正极上得电子形成氢气在铜片上冒出)。
③电流方向:正极→导线→负极→电解质溶液→正极。
④两极电极反应式
负极(锌极):Zn-2e-===Zn2+(氧化反应)。正极(铜极):2H++2e-===H2(还原反应)。总反应:Zn+2H+===Zn2++H2↑。
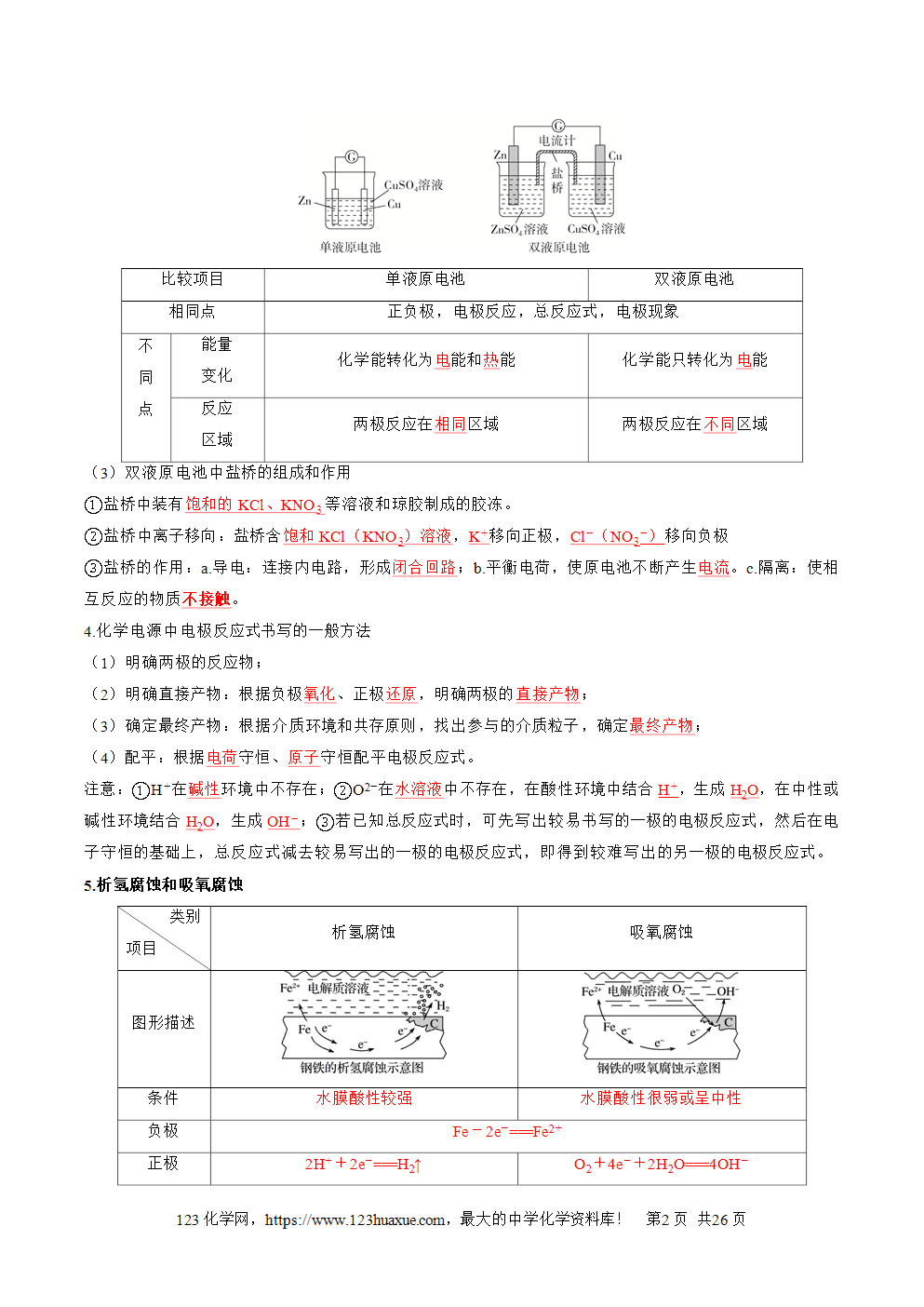
(2)单液原电池和双液原电池对比