【易错点01】“四同”的判断方法
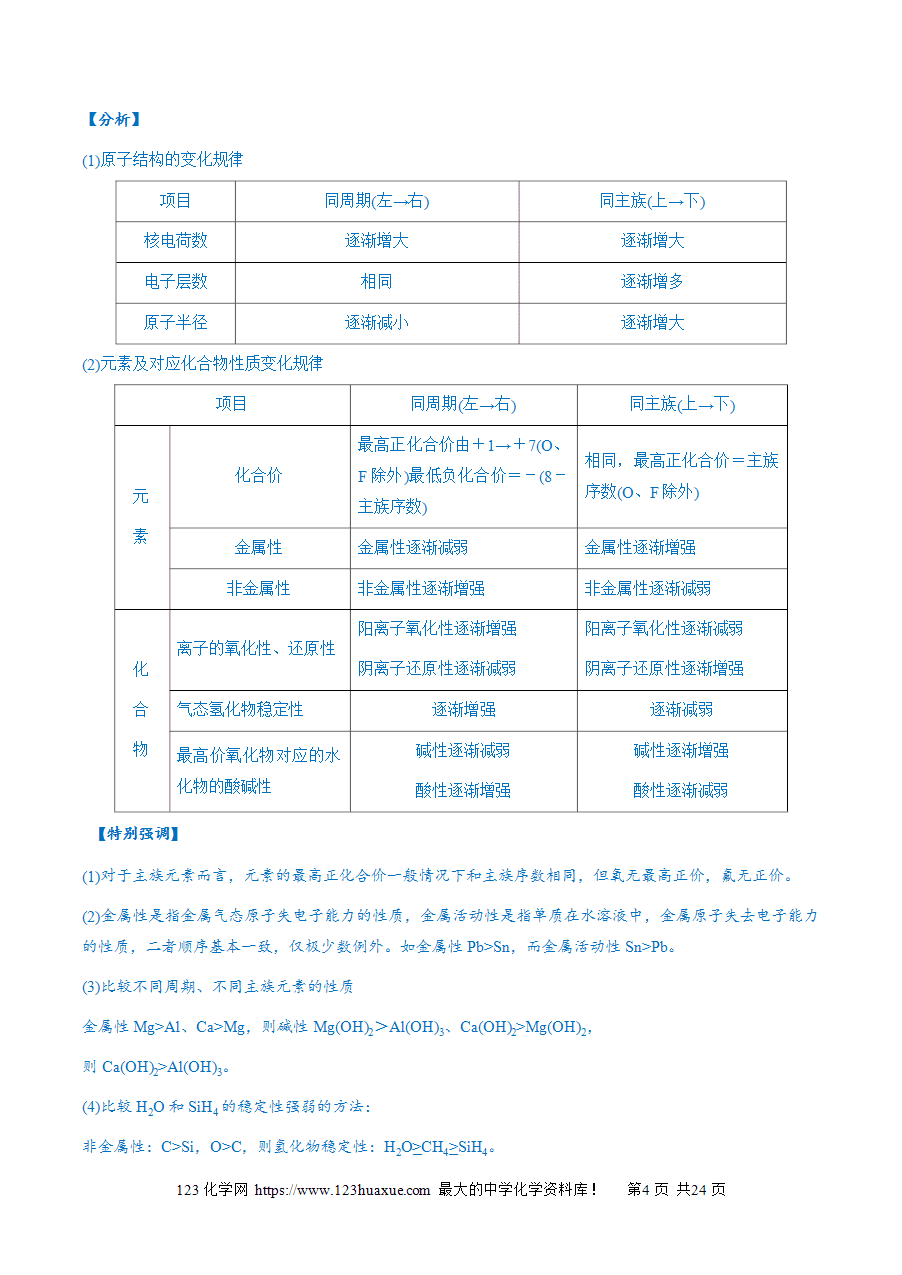
【分析】
1.判断的关键是抓住描述的对象。
(1)同位素——原子,如H、H、H;
(2)同素异形体——单质,如O2、O3;
(3)同系物——有机化合物,如CH3CH3、CH3CH2CH3;
(4)同分异构体——有机化合物,如正戊烷、异戊烷、新戊烷。
2.元素、核素、同位素的关系
【特别强调】
(1)并非所有的原子都含有中子,H原子核中只有一个质子,没有中子。
(2)一种元素可有若干种不同的核素,也可只有一种核素,因此核素的种类大于元素的种类。
(3)1H2和2H2既不是同位素,也不是同素异形体。
(4)质子数相同的微粒不一定属于同一种元素,如F与OH-。
(5)核外电子数相同的微粒,其质子数不一定相同,如Al3+与Na+、F-等,NH与OH-等。
(4)不同的核素可能具有相同的质子数,如H与H;也可能具有相同的中子数,如C与O;也可能具有相同的质量数,如C与N;也可能质子数、中子数、质量数均不相同,如H与C。
(5)同位素的物理性质不同,但化学性质几乎相同。
(6)不同核素之间的转化属于核反应,不属于化学反应。
【易错点02】不能准确判断10电子体和18电子体
【分析】
10电子体和18电子体是元素推断题的重要突破口。
(1)以Ne为中心记忆10电子体
(2)以Ar为中心记忆18电子体
此外,由10电子体中的CH4、NH3、H2O、HF失去一个H剩余部分的—CH3、—NH2、—OH、—F为9电子体,两两组合得到的物质如CH3CH3、CH3OH、H2O2、N2H4、F2等也为18电子体。