易错点1 化学反应速率的表示和单位
【分析】
化学反应速率
(1)表示方法
通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示。
(2)数学表达式及单位
v=,单位为mol·L-1·s-1或mol·L-1·min-1。
注意:①一般不用固体或纯液体物质表示化学反应速率。
②由v=计算得到的是一段时间内的平均速率,用不同物质表示时,其数值可能不同,但意义相同。
易错点2 速率常数和速率方程
【分析】
速率常数和速率方程
(1)速率常数(k)是指在给定温度下,反应物浓度皆为1 mol·L-1时的反应速率。在相同浓度的条件下,可用速率常数大小来比较化学反应的反应速率。
化学反应速率与反应物浓度(或浓度的次方)成正比,而速率常数是其比例常数,在恒温条件下,速率常数不随反应物浓度的变化而改变。因此,可以应用速率方程求出该温度下任意浓度时的反应速率。
(2)速率方程
一定温度下,化学反应速率与反应物浓度以其计量数为指数的幂的乘积成正比。
对于反应:aA+bB===gG+hH
则v=k·ca(A)·cb(B)(其中k为速率常数)。
如:①SO2Cl2SO2+Cl2 v=k1·c(SO2Cl2)
②2NO22NO+O2 v=k2·c2(NO2)
③2H2+2NON2+2H2O v=k3·c2(H2)·c2(NO)
(3)速率常数的影响因素
温度对化学反应速率的影响是显著的,速率常数是温度的函数。同一反应,温度不同,速率常数将有不同的值,但浓度不影响速率常数。
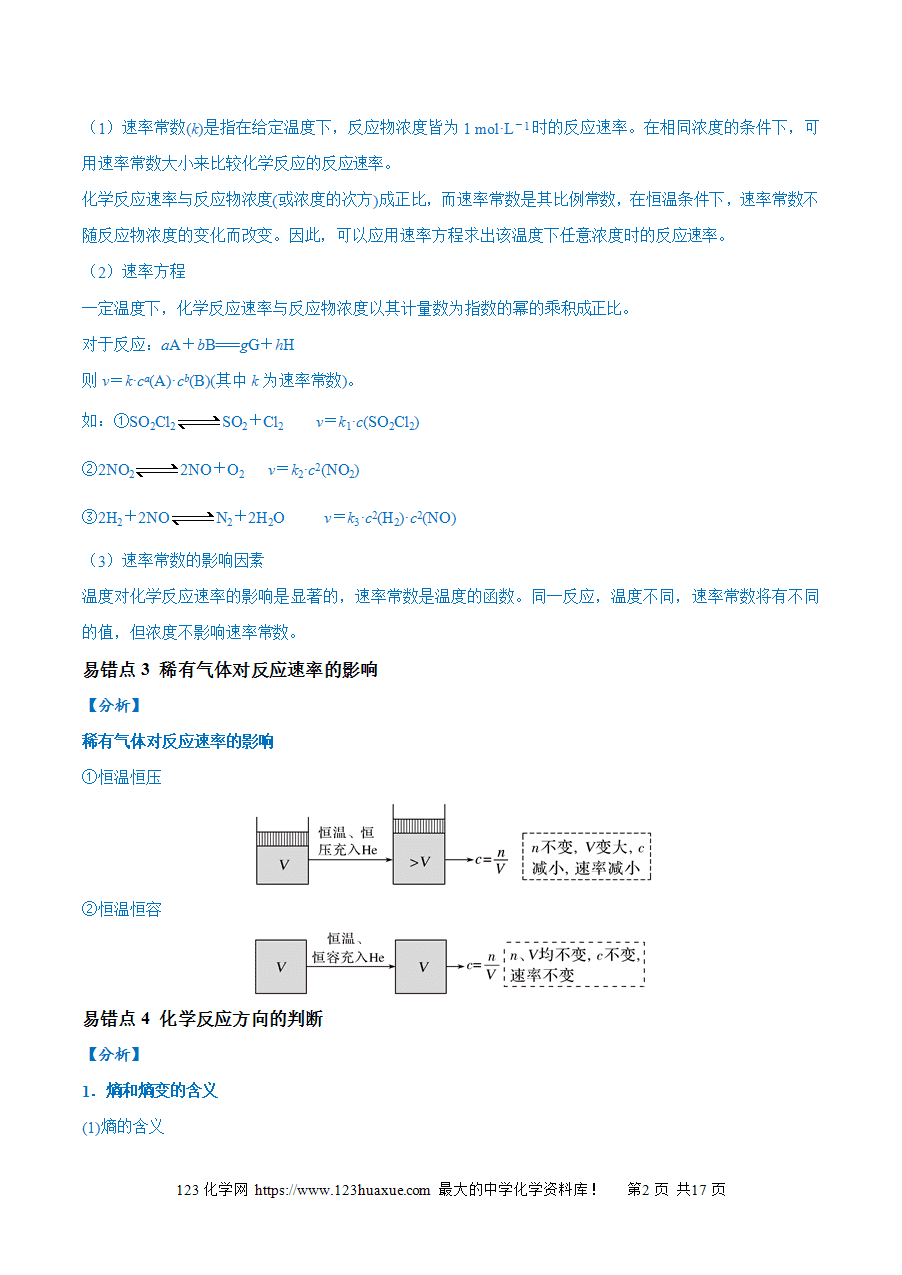
易错点3 稀有气体对反应速率的影响
【分析】
稀有气体对反应速率的影响