
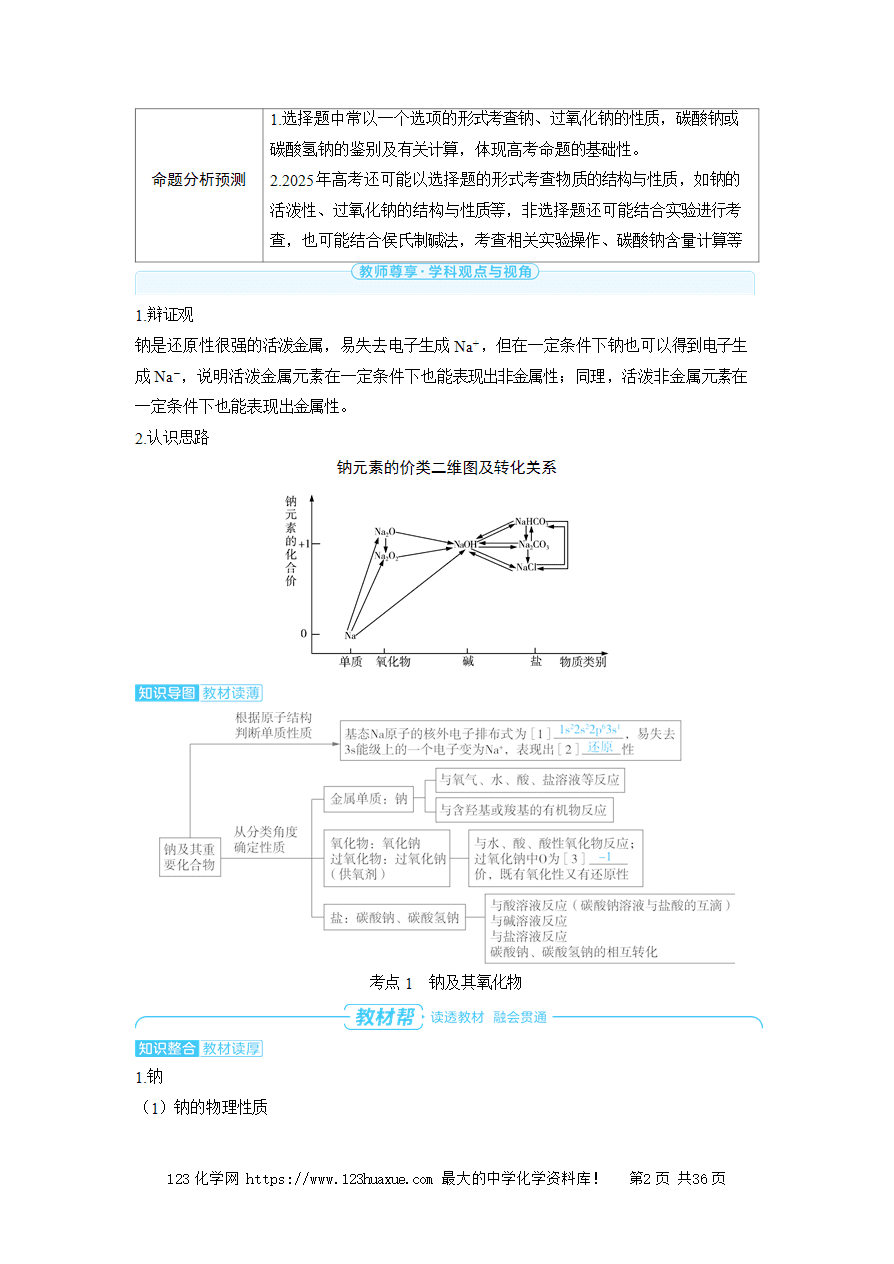
1.钠
(1)钠的物理性质
[1] 银白 色,有金属光泽的固体,质地[2] 柔软 ,熔点[3] 低 (小于100 ℃),密度比水的[4] 小 ,但比煤油的[5] 大 。
(2)从Na的原子结构角度认识钠的化学性质——还原性
①与非金属单质(如O2、Cl2)的反应
O2
Cl2:[8] 2Na+Cl22NaCl 。
②与水反应
[9] 2Na+2H2O2NaOH+H2↑ 。
③与强酸(如稀硫酸)反应:[10] 2Na+2H+2Na++H2↑ (离子方程式)。
④与盐溶液反应
与盐溶液反应时一般先与水反应,生成的NaOH与盐可能发生复分解反应。
如与CuSO4溶液反应:2Na+2H2O2NaOH+H2↑,2NaOH+CuSO4Cu(OH)2↓+Na2SO4。总反应为[11] 2Na+2H2O+CuSO4Cu(OH)2↓+Na2SO4+H2↑ 。
⑤与含羟基或羧基的有机物发生置换反应
a.与乙醇反应:2C2H5OH+2Na2C2H5ONa+H2↑。
b.与丙酸反应:2C2H5COOH+2Na2C2H5COONa+H2↑。
(3)钠的制取、保存及取用、用途




资料标签: