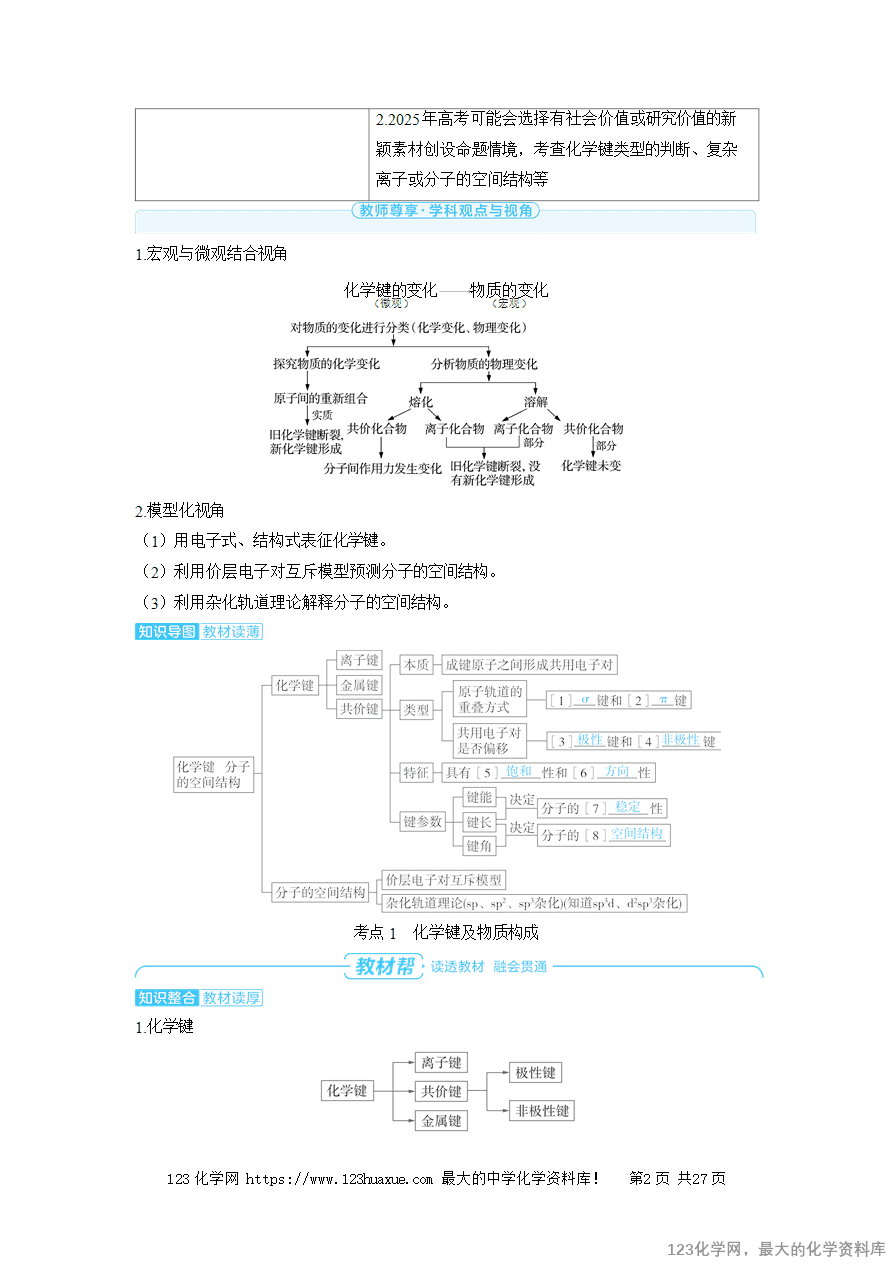
1.易错辨析。
(1)化学键是相邻离子或原子间的强烈的作用力,既包括静电吸引力,又包括静电排斥力。( √ )
(2)所有物质中都存在化学键。( ✕ )
(3)所有的共价键都具有方向性。( ✕ )
(4)由金属元素与非金属元素形成的化学键都是离子键。( ✕ )
(5)非金属元素的两个原子之间形成的一定是共价键,但多个原子间也可能形成离子键。( √ )
(6)离子化合物中可能含有共价键,共价化合物中一定不含离子键。( √ )
(7)NaOH中含有离子键和共价键。( √ )
(8)某物质熔融状态能导电,可以证明该物质内一定存在离子键。( ✕ )
(9)单质分子中一定含有非极性共价键。( ✕ )
(10)两个s轨道只能形成σ键,不能形成π键。( √ )
(11)多原子分子中一定含有σ键,可能含有π键。( √ )
(12)共价单键都是σ键。( √ )
(13)共价三键中,一个是π键,另两个是σ键。( ✕ )
(14)C2H4与Cl2的加成反应只涉及π键断裂。( ✕ )
(15)N2分子中σ键与π键的数目比n(σ)∶n(π)为1∶2。( √ )
2.请写出下列物质所含共价键的数目。
(1)丙炔的结构简式为 ,则丙炔分子中含有 6 个σ键和 2 个π键;
(2)(CN)2为直线形分子,含有 3 个σ键和 4 个π键;
(3)乙烷分子中含有 7 个σ键和 0 个π键;
(4)乙醇分子中含有 7 个极性共价键, 1 个非极性共价键, 8 个σ键, 0 个π键;
(5)乙烯分子中含有 5 个σ键和 1 个π键。
3.F—F的键长比Cl—Cl的键长短,但F—F的键能却比Cl—Cl的键能小,原因是 氟原子的半径很小,两个氟原子在形成共价键时,原子核之间的距离很小,排斥力很大 。
4.试从键能、键长角度解释乙烯、乙炔比乙烷活泼的原因 虽然键长C≡C<CC<C—C,键能C≡C>CC>C—C,但乙烯、乙炔在发生加成反应时,只有π键断裂(π键的键能一般小于σ键的键能) 。
5.[全国Ⅰ高考]Ge与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因是 Ge原子半径大,原子间形成的σ键较长,p轨道与p轨道“肩并肩”重叠程度很小或几乎不能重叠,难以形成π键 。
6.下列物质中:①MgCl2;②Na2O2;③CS2;④NaOH;⑤H2;⑥Ne
(1)只存在极性键的是 ③ (填序号,下同)。
(2)只存在非极性键的是 ⑤ ,只存在离子键的是 ① 。
(3)既存在离子键又存在极性共价键的是 ④ ,既存在离子键又存在非极性共价键的是