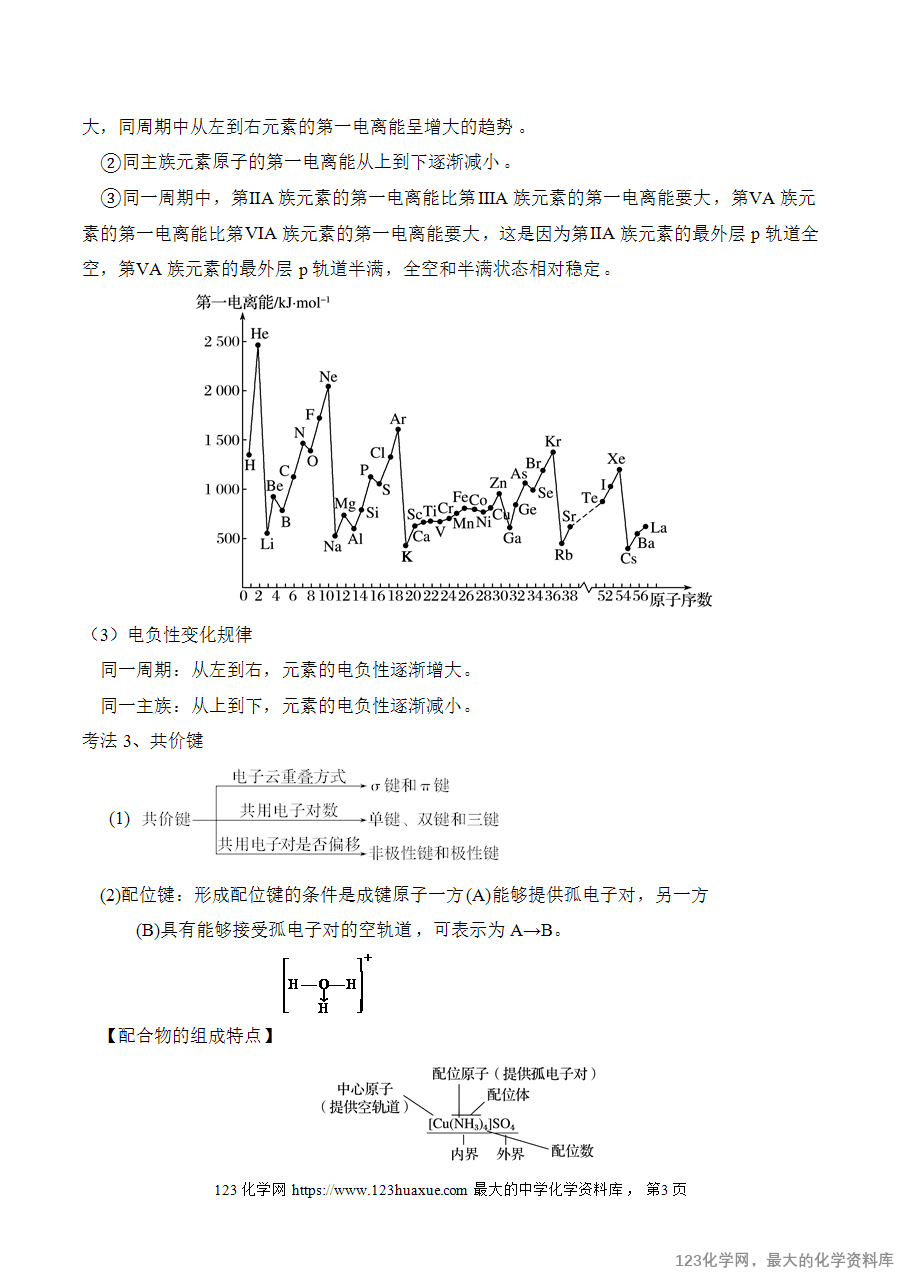
第一电离能的递变规律
第一电离能的递变规律①每个周期的第一种元素(氢和碱金属)第一电离能最小,稀有气体元素原子的第一电离能最大,同周期中从左到右元素的第一电离能呈增大的趋势。
②同主族元素原子的第一电离能从上到下逐渐减小。
③同一周期中,第ⅡA族元素的第一电离能比第ⅢA族元素的第一电离能要大,第ⅤA族元素的第一电离能比第ⅥA族元素的第一电离能要大,这是因为第ⅡA族元素的最外层p轨道全空,第ⅤA族元素的最外层p轨道半满,全空和半满状态相对稳定。
(3)电负性变化规律
同一周期:从左到右,元素的电负性逐渐增大。
同一主族:从上到下,元素的电负性逐渐减小。
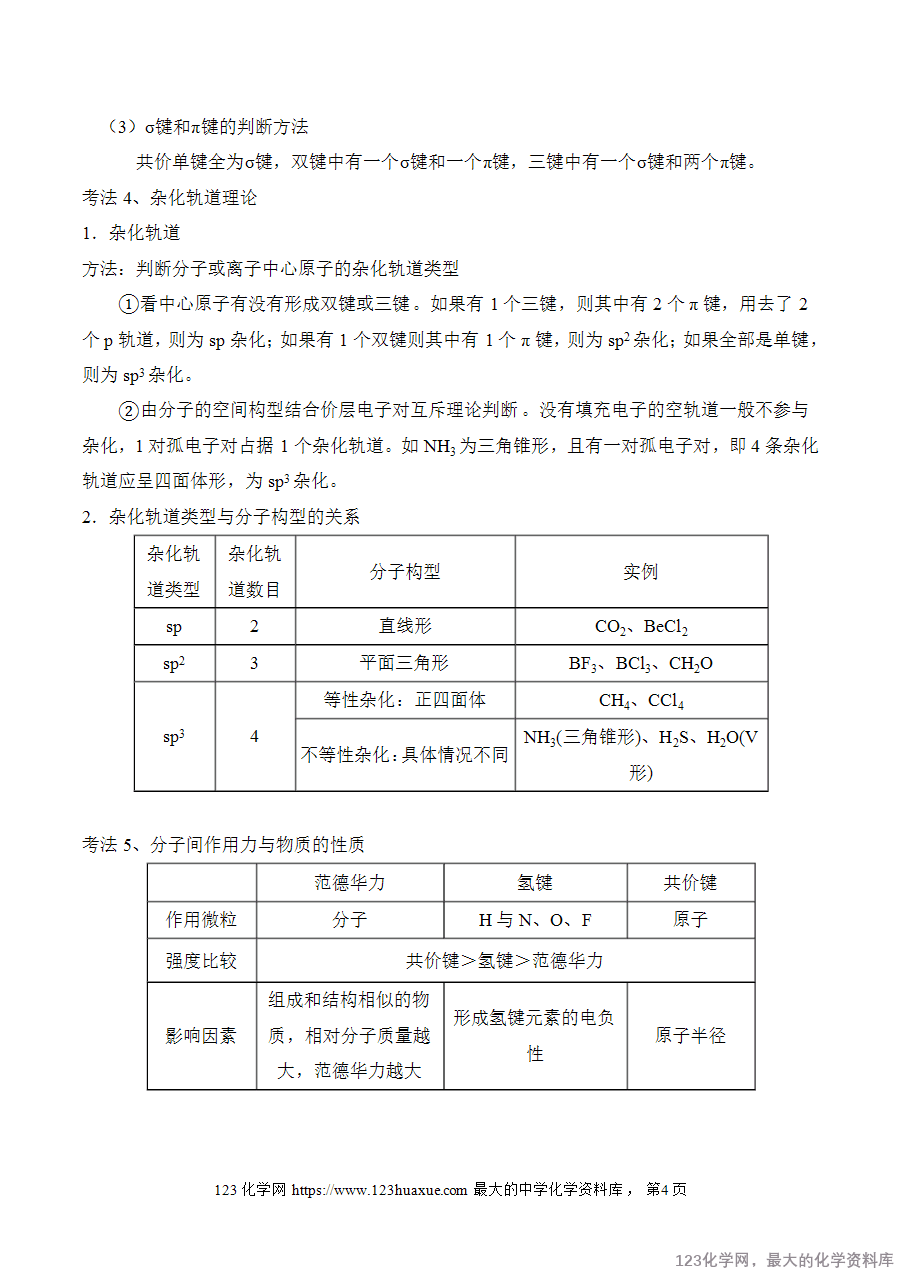
考法3、共价键
(1)
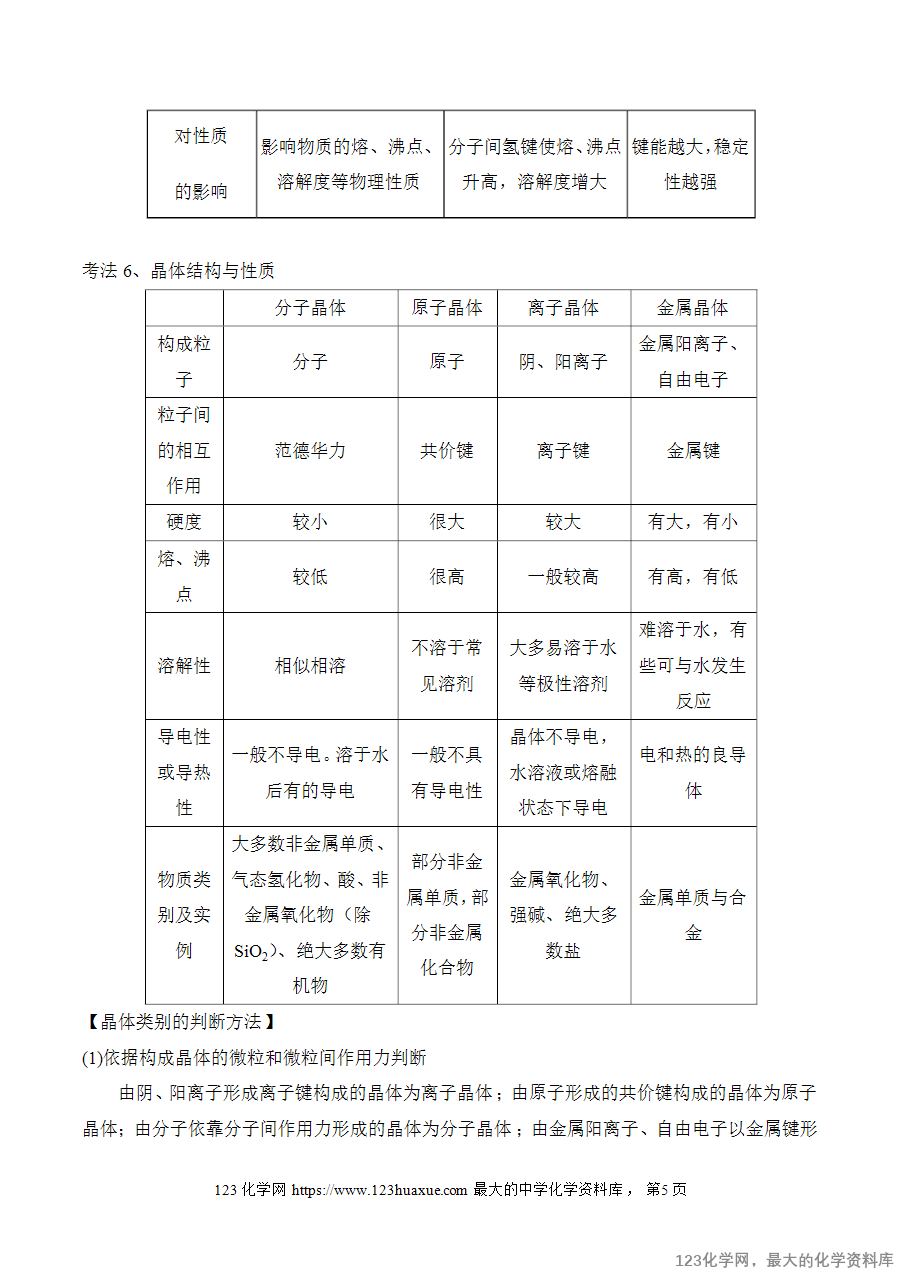
(2)配位键:形成配位键的条件是成键原子一方(A)能够提供孤电子对,另一方
(B)具有能够接受孤电子对的空轨道,可表示为A→B。