1.分析电化学装置的物质变化书写电极反应式
(1)确定装置类型
原电池:外接用电器、电压表、负载等;
电解池:外接电源或题干给出信息;
二次电池:放电为原电池、充电为电解池。
(2)“四步法”书写电极反应式
2.已知总反应式,书写电极反应式
(1)书写三步骤
步骤一:根据电池总反应式,标出电子转移的方向和数目(ne-)。
步骤二:找出正(阴)、负(阳)极,失电子的电极为负(阳)极;确定溶液的酸碱性。
步骤三:写电极反应式。
负(阳)极反应:还原剂-ne-===氧化产物
正(阴)极反应:氧化剂+ne-===还原产物
(2)书写技巧
若某电极反应式较难写出时,可先写出较易的电极反应式,然后根据得失电子守恒,用总反应式减去较易的电极反应式,即可得出较难写出的电极反应式。
3.守恒法在电化学计算中的应用
(1)电子守恒和电荷守恒列关系式
①电子守恒:两极得失电子数相等。
②电荷守恒:1个电子对应1个正电荷(或负电荷)。
③常用关系式:O2~4e-~4Ag~2Cu~2H2~2Cl2~4OH-~4H+~Mn+。
(2)几个注意问题
①气体体积相关计算时,必须注明标准状况。
②计算含交换膜电化学装置中某一区域质量变化,注意离子的迁移。
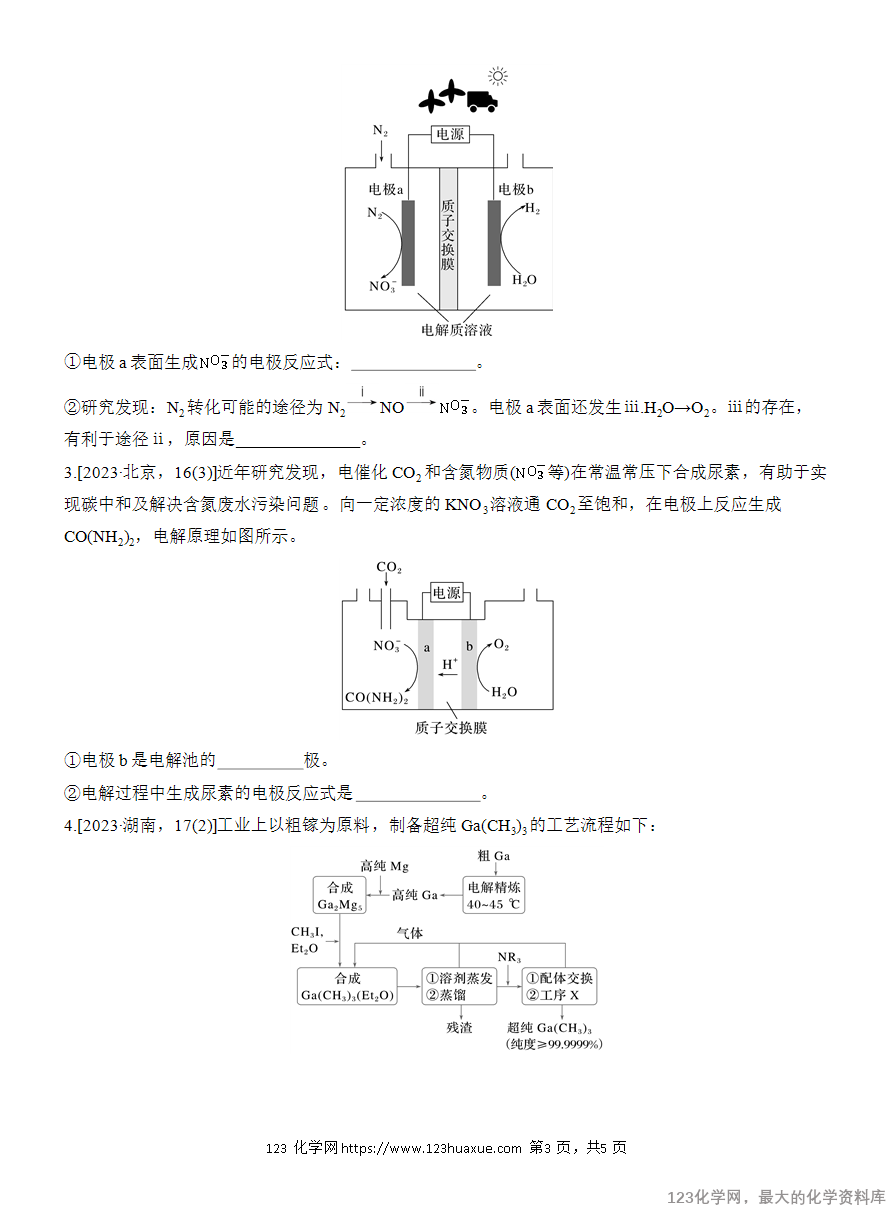
例 盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上采用如图所示装置进行制备。不考虑溶液体积的变化。