1.基元反应与非基元反应
例如H++OH-===H2O是反应物一步直接转化为生成物的,其总反应就是基元反应,又称为简单反应;而2HI===H2+I2的实际机理是分两步进行的,每一步都是一个基元反应:2HI―→H2+2I·、2I·―→I2,带有单电子的原子或原子团称为自由基,反应活性高, 寿命短,2HI===H2 + I2称为非基元反应。
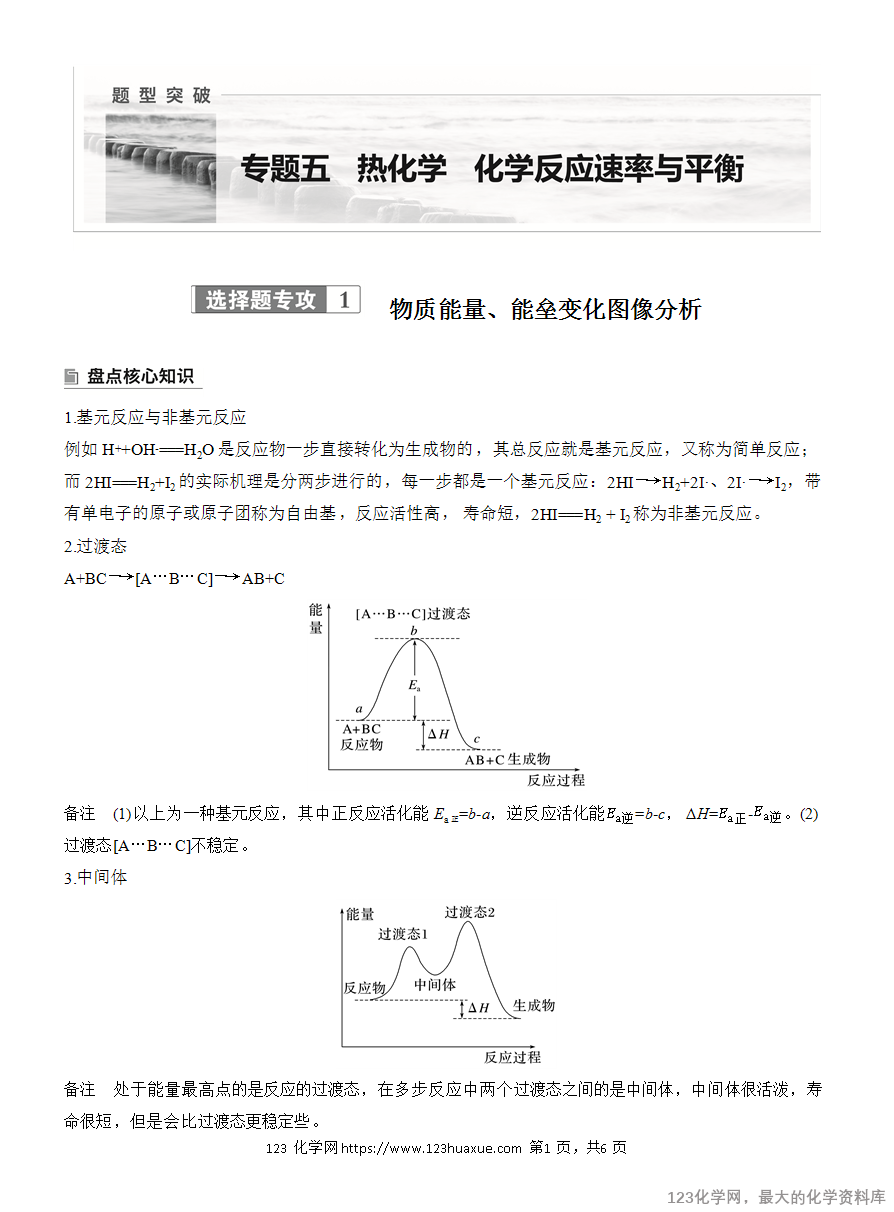
2.过渡态
A+BC―→[A…B…C]―→AB+C
备注 (1)以上为一种基元反应,其中正反应活化能Ea正=b-a,逆反应活化能=b-c, ΔH=-。(2)过渡态[A…B…C]不稳定。
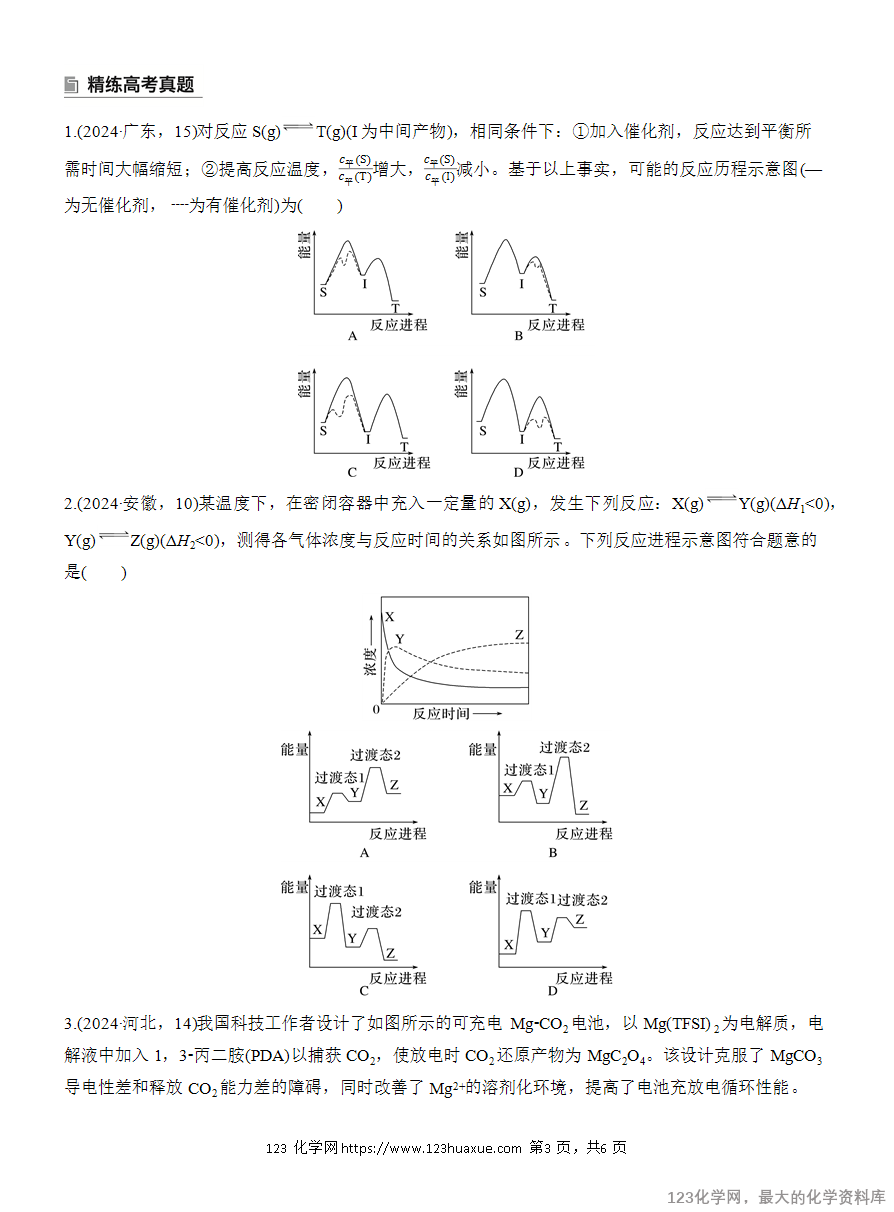
3.中间体
备注 处于能量最高点的是反应的过渡态,在多步反应中两个过渡态之间的是中间体,中间体很活泼,寿命很短,但是会比过渡态更稳定些。
4.催化机理能垒图
(1)在催化机理能垒图中,有几个活化状态,就有几个基元反应。可以用图中每步基元反应前后的活性物质,写出其热化学方程式。注意:如果纵坐标相对能量的单位是电子伏特(eV),焓变应转化成每摩尔。
(2)每步基元反应的快慢取决于其能垒的大小,能垒越大,反应速率越慢。
例如:在Rh催化下,甲酸分解制H2反应的过程如图所示。
其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为 ;
甲酸分解制H2的热化学方程式可表示为 (阿伏加德罗常数的值用NA表示)。