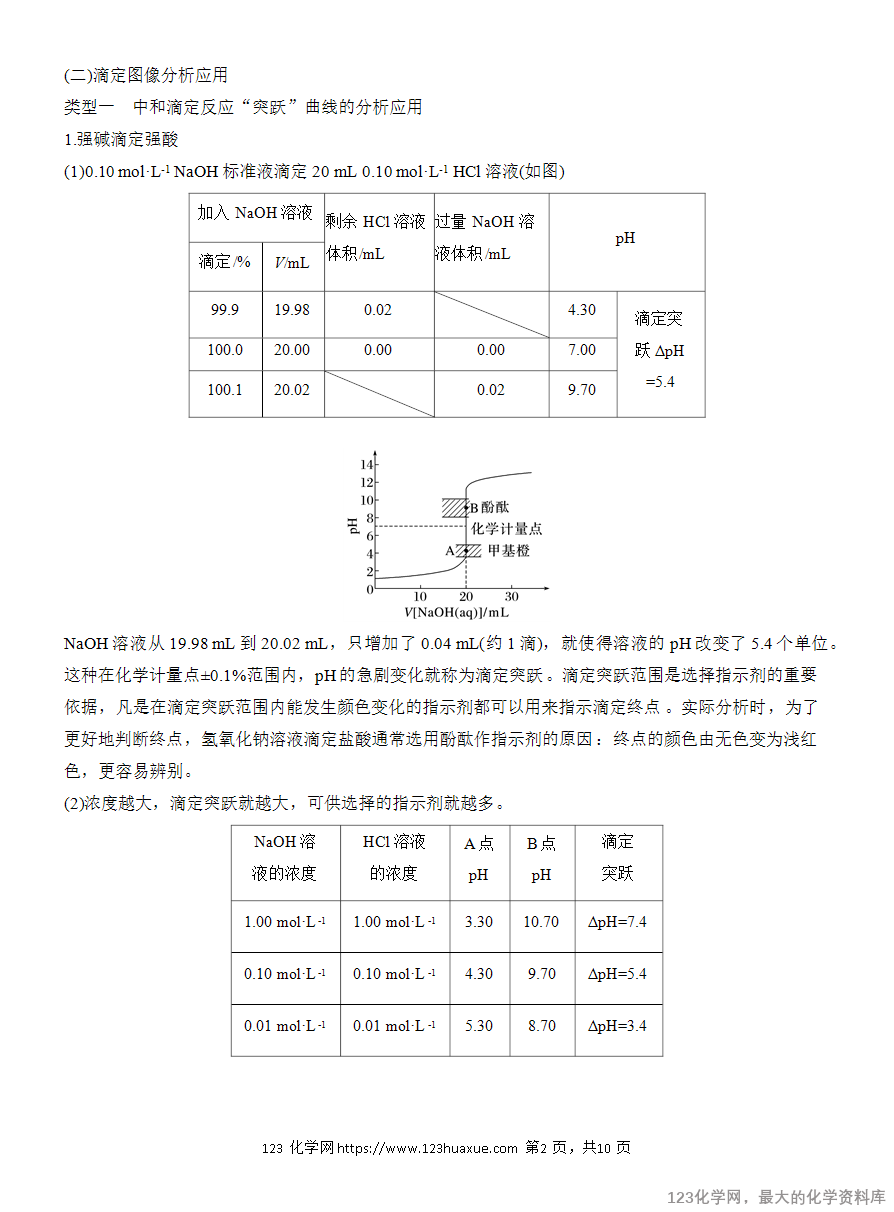
溶液中的离子浓度关系与滴定曲线分析
溶液中的离子浓度关系与滴定曲线分析(一)溶液中的离子浓度关系
1.解题模型——分清主次,抓主要矛盾
例1 单一溶液
(1)0.1 mol·L-1 H2S溶液中离子浓度大小关系: 。
(2)NaHS溶液中离子浓度大小关系: 。
例2 物质的量浓度1∶1的缓冲溶液
等浓度的NaOH和CH3COOH按1∶2体积比混合后pH<7,离子浓度大小顺序为 。
解题策略 溶液中物质间若能发生化学反应,则优先考虑化学反应。
2.溶液中部分粒子浓度之和(差)的大小比较
解题模型
(1)先确定溶液中粒子的构成。
(2)从守恒出发,根据溶液中存在的元素守恒或电荷守恒进行分析比较。
(3)三大守恒式的书写
①电荷守恒
电解质溶液中,无论存在多少种离子,溶液都呈电中性,故存在电荷守恒,即阳离子所带正电荷总数=阴离子所带负电荷总数。
如Na2S与NaHS的混合溶液中存在电荷守恒: 。
②元素守恒
电解质溶液中,由于某些离子能够水解,离子种类增多,但元素总是守恒的,即元素守恒的特征:元素写两边、系数交叉配。
如0.1 mol·L-1 Na2CO3溶液中存在的元素守恒关系: 。
物质的量浓度1∶1的HA、 NaA的混合溶液中存在元素守恒: 。