
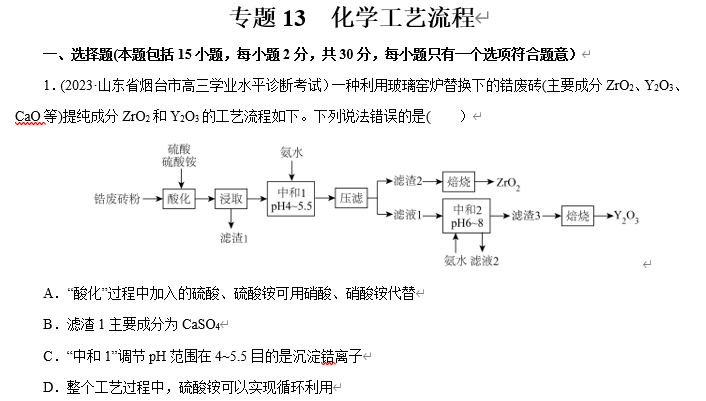
A.“酸化”过程中加入的硫酸、硫酸铵可用硝酸、硝酸铵代替
B.滤渣1主要成分为CaSO4
C.“中和1”调节pH范围在4~5.5目的是沉淀锆离子
D.整个工艺过程中,硫酸铵可以实现循环利用
【答案】A
【解析】锆废砖(主要成分ZrO2、Y2O3、CaO等)提纯氧化锆和氧化钇,锆废砖加入硫酸和硫酸铵,得到硫酸钙沉淀,调节溶液pH在4 ~ 5.5范围沉淀锆离子,压滤,得到滤渣2为Zr(OH)4,焙烧得到ZrO2;滤液继续加入氨水调节溶液pH在6~ 8得Y(OH)3,过滤得滤液为滤液2为硫酸铵和氨水,滤渣水洗、煅烧得到Y2O3粉末。A项,若硫酸用硝酸代替,则反应过程硝酸和CaO反应产生Ca(NO3)2,就不能形成生成CaSO4沉淀而除去Ca2+,A错误;B项,根据上述分析可知滤渣1主要成分为CaSO4,B正确;C项,“中和1”调节pH范围在4~5.5目的是使沉淀锆离子使之转化为Zr(OH)4,C正确;D项,滤液2为硫酸铍和氨水,酸化后可以返回“酸化”使用,故硫酸铵循环利用,D正确;故选A。
2.(2023·江苏省南京市江宁区高三期中)工业上常用芒硝( Na2SO4·10H2O)和煤粉在高温下生产硫化钠粗品,生产的硫化钠粗品中常含有一定量的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。一种生产芒硝并进行纯化的流程如下图所示:
下列说法不正确的是( )
A.Na2SO4·10H2O和煤粉高温下反应所得CO和Na2S的物质的量之比为2∶1
B.“溶解”时需要适当升高温度
C.“操作Ⅰ”是趁热过滤
D.含少量Na2S的乙醇可通过蒸馏的方法回收乙醇
【答案】A
【解析】A项,Na2SO4·10H2O和煤粉高温下反应所得CO和Na2S,反应中碳元素化合价由0价升高到+2价,升高了2,CO是氧化产物,硫元素由+6价降到-2价,降低了8,Na2S为还原产物,根据得失电子守恒,反应所得CO和Na2S的物质的量之比为4∶1,A错误;B项,乙醇做溶剂溶解硫化钠,因为硫化钠易溶于热乙醇,“溶解”时需要适当升高温度,B正确;C项,硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇,趁热过滤,防止温度降低,硫化钠析出,降低产率,C正确;D项,含少量Na2S的乙醇可通过蒸馏的方法回收乙醇,D正确;故选A。
3.(2023·江西省部分学校高三质量检测)Li2CO3是重要的工业原料。以废旧锂离子电池的正极材料(主要含有LiCoO2及少量 等)为原料生产Li2CO3的一种工艺流程如图所示:
已知LiCoO2难溶于水,具有强氧化性。
下列说法正确的是( )
A.滤液1中含有的阳离子主要是Al3+和Na+
B.“还原”时,参加反应
C.滤渣主要是Fe(OH)3,滤液2中仅含有一种溶质
D.“沉钴”离子方程式为Co2++HCO3-= CoCO3↓+2H+
【答案】B
【解析】正极材料主要含LiCoO2、Al、Fe,加入NaOH 溶液,Al 与 NaOH 反应生成 NaAlO2溶液,Fe不反应,剩余的Fe与 H2SO4溶液反应生成Fe2+,LiCoO2与酸反应生成Co3+,Co3+具有氧化性,与Na2SO3反应CoSO4和Li2SO4,加入氨水调节pH使Fe2+沉淀,Fe2+和氢氧根离子反应生成氢氧化亚铁沉淀,但氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁沉淀,所以废渣的成分是氢氧化铁,加入NH4HCO3溶液沉钴,得到滤液 Y为 LiSO4 溶液,加入Na2CO3得到Li2CO3沉淀。A项,滤液1中含有的阳离子主要是Na+,Al以AlO2-的形式存在,A项错误;B项,“还原”时,Co3+具有氧化性,与Na2SO3反应CoSO4和Li2SO4,反应离子方程式为 ,参加反应 ,B项正确;C项,滤渣主要是
Fe(OH)3,滤液2中含 ,C项错误;D项,“沉钴”离子方程式为Co2++2HCO3-= CoCO3↓+H2O+CO2↑,D项错误;故选B。
4.(2023·山东省临沂市高三期中)一种以辉钼矿(主要成分是MoS2,还含有NiS、PbS、SiO2