
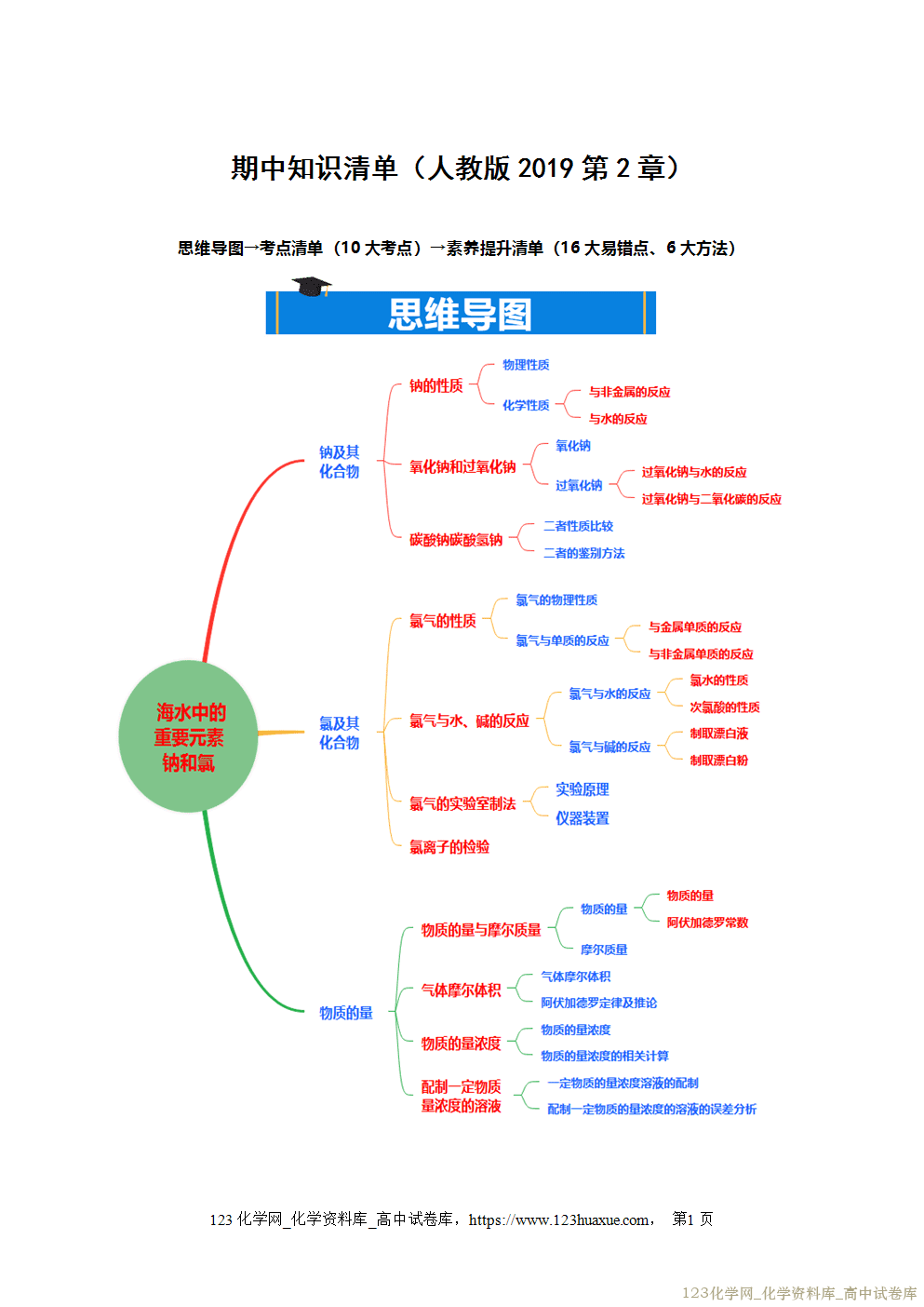







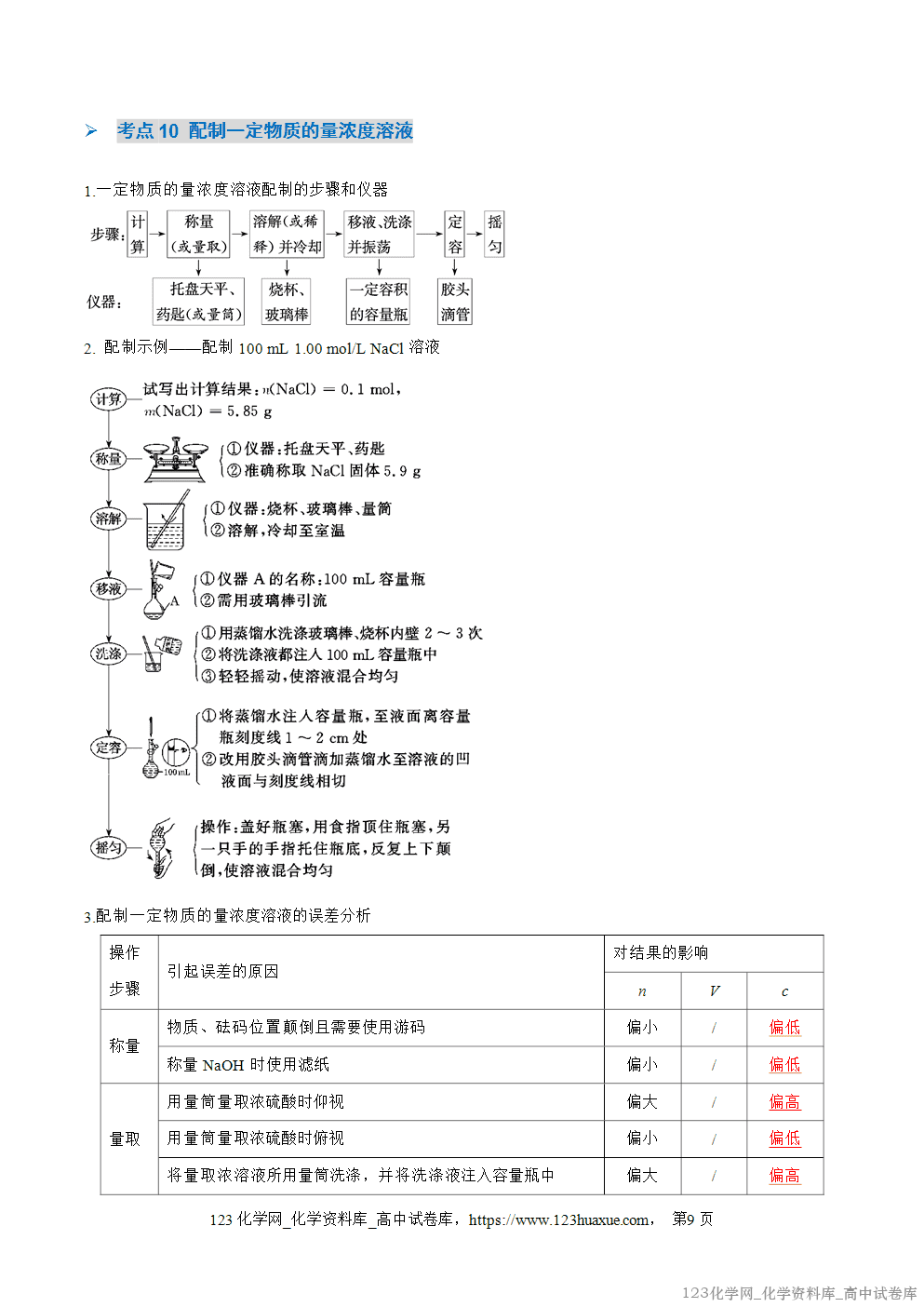


电离方程式的书写方法
(1)强酸、强碱、大部分盐书写时用“===”连接,如HCl===H++Cl-、NaCl===Na++Cl-。
(2)酸式盐的电离方程式
①强酸的酸式盐在水溶液中完全电离,如在水溶液中NaHSO4的电离方程式为NaHSO4===Na++H++SO4(2-),熔融状态下NaHSO4的电离方程式为NaHSO4===Na++HSO4(-) 。
②弱酸的酸式盐在水溶液中电离生成酸式酸根阴离子和阳离子,如NaHCO3===Na++HCO3(-)。
(3)电离方程式的书写注意事项
①方程式左边书写化学式,表示电解质还未电离时的状态;右边书写离子符号,表示电解质电离产生的离子。
②书写时要遵循质量守恒(即方程式两边原子种类、个数相等)和电荷守恒(即电离产生的阳离子所带正电荷总数等于阴离子所带负电荷总数)。
③书写电离方程式必须以事实为依据,不能主观臆造。
3.电解质溶液的导电能力
(1)电解质溶液的导电能力与单位体积内电解质电离的离子数目及相应离子所带电荷多少有关,单位体积内电解质电离的离子数目越大,相应离子所带电荷越多,导电能力越强。
(2)判断电解质是否导电,关键要看电解质是否发生电离产生了自由移动的离子,还要看单位体积内电解质电离的离子数目的多少,如CaCO3在水中的溶解度很小,故认为其水溶液导电能力很弱。