







易错点01焓变
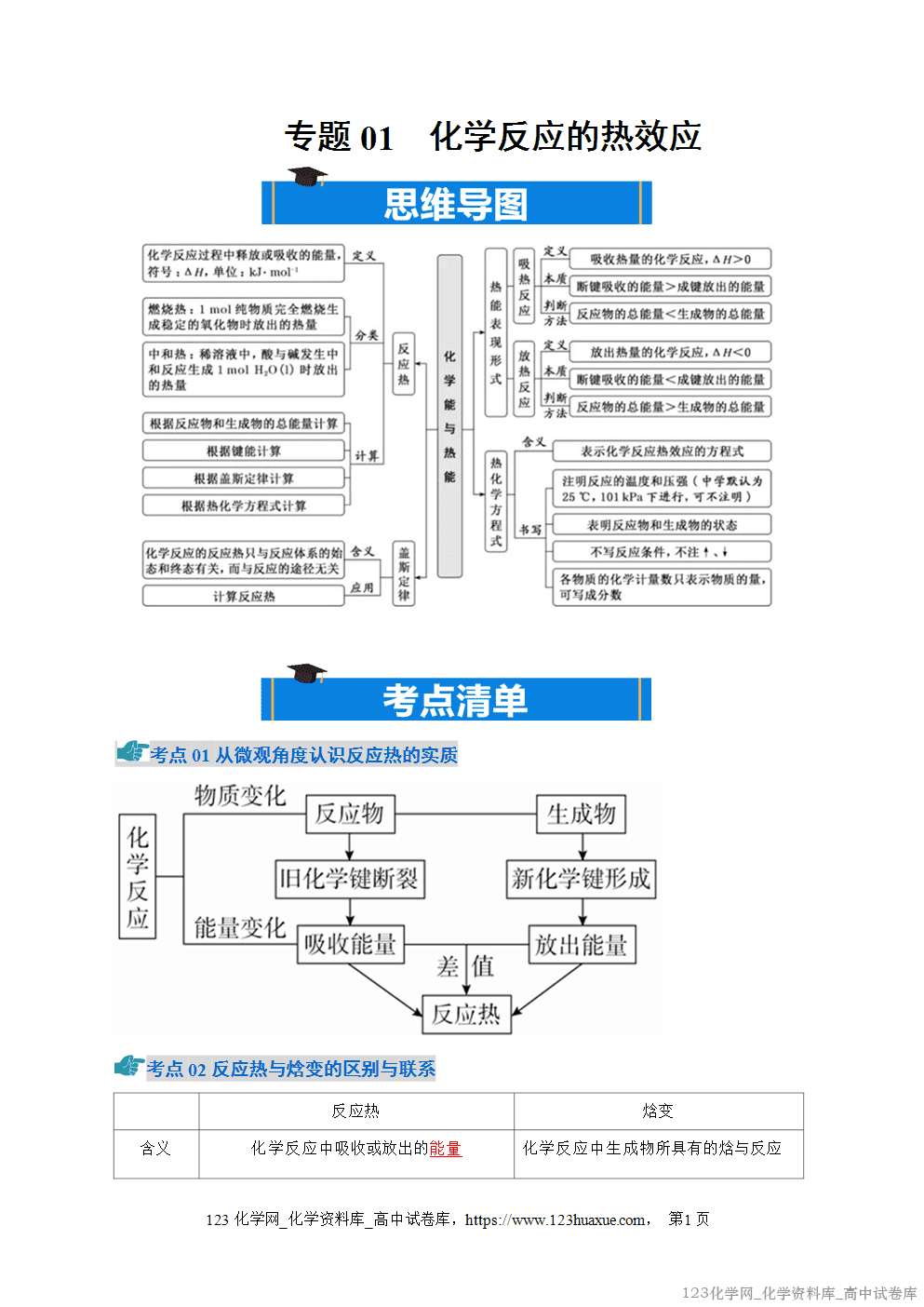
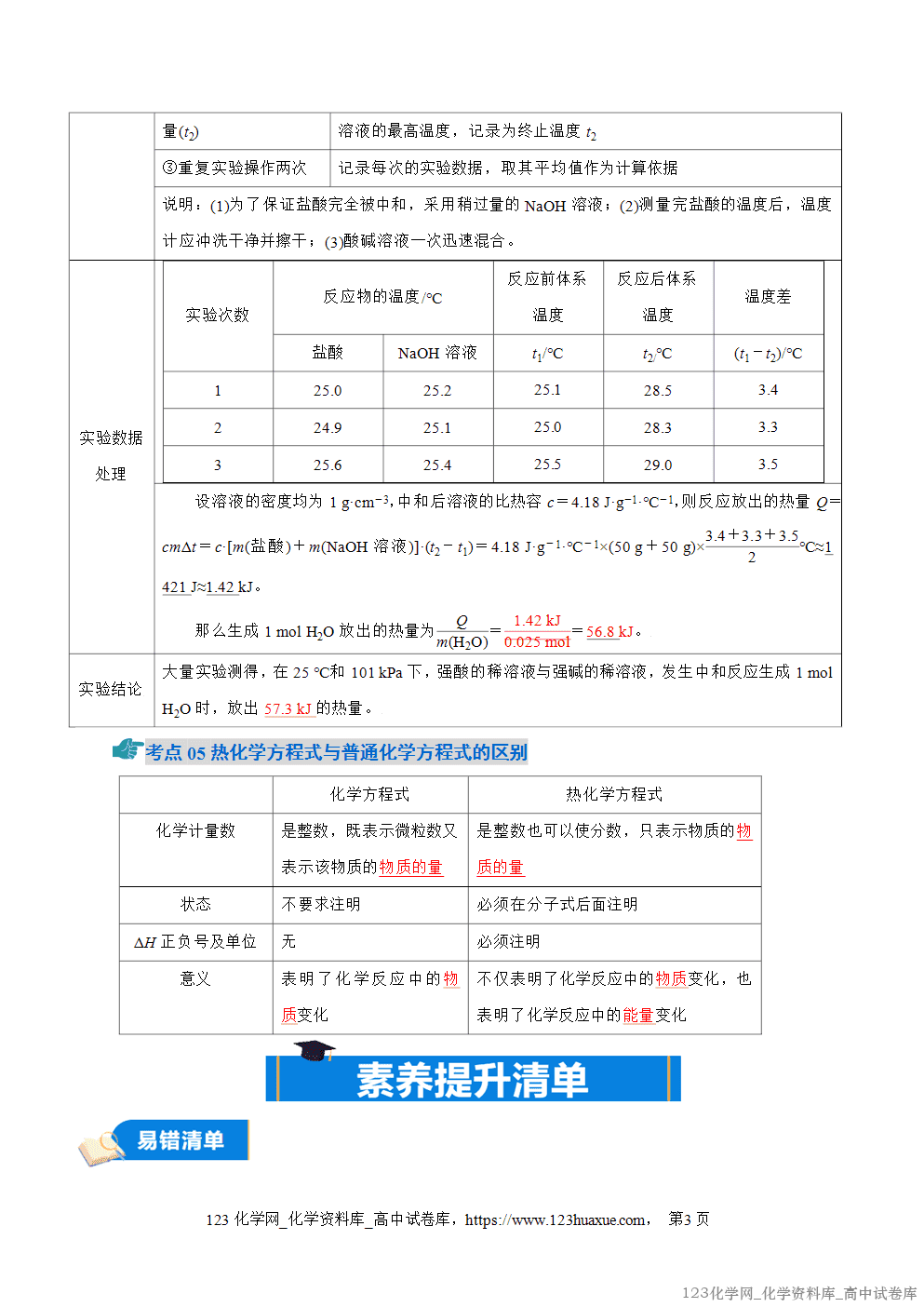
1.任何化学反应都有反应热,即ΔH≠0;一定条件下,ΔH的大小与反应条件无关。
2.一定条件下,用H表示物质所具有的能量,反应的焓变为生成物的总能量与反应物总能量之差,即ΔH=H(生成物)-H(反应物)。
3.比较ΔH大小时,要连同“+”“-”包含在内,类似于数学上的正、 负数比较。
4.从反应物断键和生成物成键角度理解反应热。
5.焓:焓是物质所具有的能量,是与内能有关的物理量,符号为H。
6.焓变(ΔH):生成物的焓值与反应物的焓值之差,用ΔH表示。
①单位:kJ/mol 或kJ·mol-1;
②规定:放热反应,体系焓减小,ΔH<0,即∆H为“-”;吸热反应,体系焓增大,ΔH>0,即 ∆H 为“+”。
【判断对错】
(1)所有的化学反应都伴有能量的变化( )
(2)浓硫酸溶于水时,体系的温度升高,该过程属于放热反应( )
(3)焓变单位中kJ·mol-1,是指1 mol物质参加反应时的能量变化( )
(4)当反应放热时ΔH>0,反应吸热时ΔH<0( )
(5)一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为“-”( )
(6)一个化学反应中,生成物总键能大于反应物的总键能时,反应吸热,ΔH为“+”( )
(7)在同一反应中,焓变和反应热的数值是相等的( )
(8)有化学键破坏的一定是化学反应,且一定伴随着能量的变化( )
(9)一个化学反应中,反应物总能量大于生成物的总能量时,反应放热,ΔH<0( )
(10)反应体系从环境中吸收能量,反应体系的焓会减小( )
【答案】(1)√ (2)× (3)× (4)× (5)√ (6)× (7)× (8)× (9)√ (10)×