











一、化学反应速率的概念及测定
1.定义:衡量化学反应进行快慢的物理量。
2.表示方法:
(1)化学反应速率可以用单位 时间 、单位体积中反应物或生成物的物质的量变化来表示;
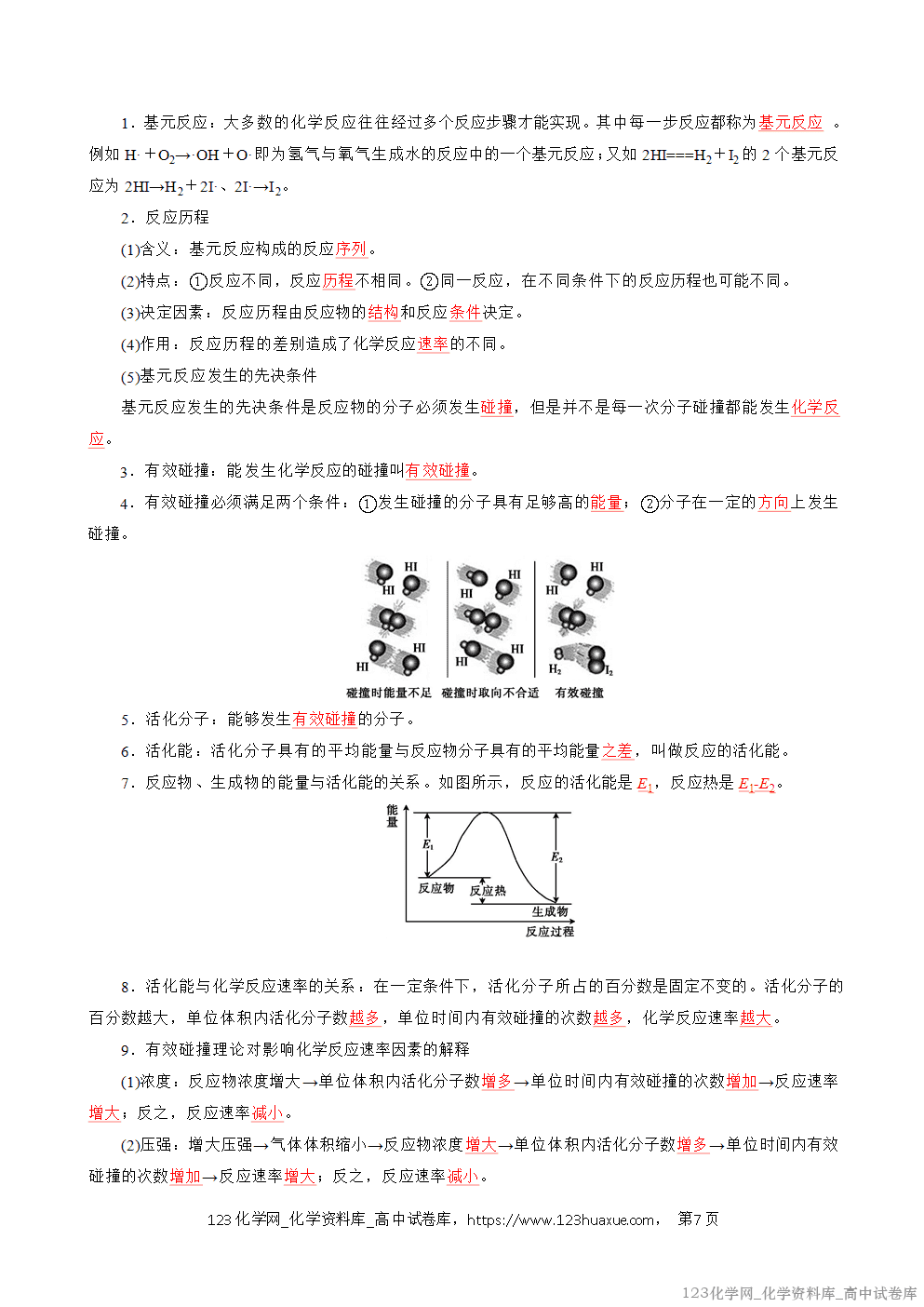
(2)如果反应体系的体积是恒定的,则通常用单位 时间 内反应物 浓度 的减少或生成物 浓度 的增加来表示。
3.表达式: v = Δt(Δc);单位:mol·L-1·s-1或mol/(L·s)、 mol·L-1·min-1或mol/(L·min)。
4.化学反应速率的特点
(1)在某一个化学反应中,无论是用反应物还是用生成物表示化学反应速率,其值均为正值。
(2)化学反应速率表示的均是某一段时间内化学反应的平均速率,而不是某一时刻化学反应的瞬时速率。
(3)一个确定的化学反应涉及反应物、生成物多种物质,因而定量表示一个化学反应的反应速率时,必须指明是用哪一种物质来表示的。
(4)在同一反应中,用不同的物质表示的化学反应速率,其数值可能不同,但表示的实际意义相同。
(5)在同一化学反应中,用各物质表示的化学反应速率之比等于化学方程式中各物质的化学计量数之比。例如,在反应aA(g)+bB(g) cC(g)+dD(g)中,v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d。
5.化学反应速率的测定
(1)定性描述:(根据实验现象)
①观察产生气泡的快、慢;
②观察试管中剩余锌粒的质量的多、少;
③用手触摸试管,感受试管外壁温度的高、低
(2)定量描述:(根据实验测量,单位时间内)
①测定气体的体积;
②测定物质的物质的量的变化;
③测定物质或离子的浓度变化;
④测定体系的温度或测定反应的热量变化。
(3)测量化学反应速率的常见方法
①量气法;②比色法;③电导法;④激光技术法
(4)化学反应速率的测量——实验
①反应原理:Zn+H2SO4=ZnSO4+H2↑